在急性心肌梗死发生后,无论是ST段抬高型心肌梗死还是非ST段抬高型心肌梗死患者,住院期间的心力衰竭发生率分别为13.6%和14.8%,1年后心力衰竭发生率分别为23.4%和25.4%,心肌梗死患者一旦进展为心力衰竭,其死亡风险增加1.5倍,因此,阻止或延缓心肌梗死进展为心力衰竭尤为重要[1]。沙库巴曲缬沙坦钠[2](诺欣妥)是首个脑啡肽酶抑制剂和血管紧张素受体结合而成的药物,一方面,通过增强利钠肽系统起到改善心肌重塑、利尿排钠作用;另一方面,通过缬沙坦抑制肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)系统,达到减轻心脏负荷,舒张血管等作用,延缓或逆转心室重构。研究显示,诺欣妥能显著降低慢性心力衰竭患者的病死率和住院率,但其对急性心肌梗死后心力衰竭患者治疗效果不明[3]。本研究就此问题,比较贝那普利、沙库巴曲缬沙坦治疗急性心肌梗死患者介入治疗后心力衰竭的效果。报告如下。
1 资料与方法
1.1 一般资料 选择2019年1月—2020年8月四川省成都市第三人民医院心内科收治的急性心肌梗死行经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)患者86例。纳入标准:①所有患者均为急性心肌梗死;②急性心肌梗死行PCI后,住院期间行心脏彩色超声提示射血分数(ejection fraction,EF)<50%;③术后有心功能不全表现,N末端B型利钠肽原(N-terminalpro-B-type natriuretic peptide,NT-proBNP)>300 μg/L。排除标准:①急性心肌梗死未行PCI治疗;②急性心肌梗死行PCI治疗后,住院期间行心脏彩色超声提示EF≥50%;③肾功能不全及严重肝功能不全患者;④有药物使用禁忌证者,不能耐受药物者。据临床治疗方法不同分为对照组(贝那普利)和观察组(诺欣妥),每组43例。2组基线资料差异无统计学意义(P>0.05),具有可比性,见表1。
表1 2组患者一般资料比较
Table 1 Comparison of baseline data between two groups (n=43)
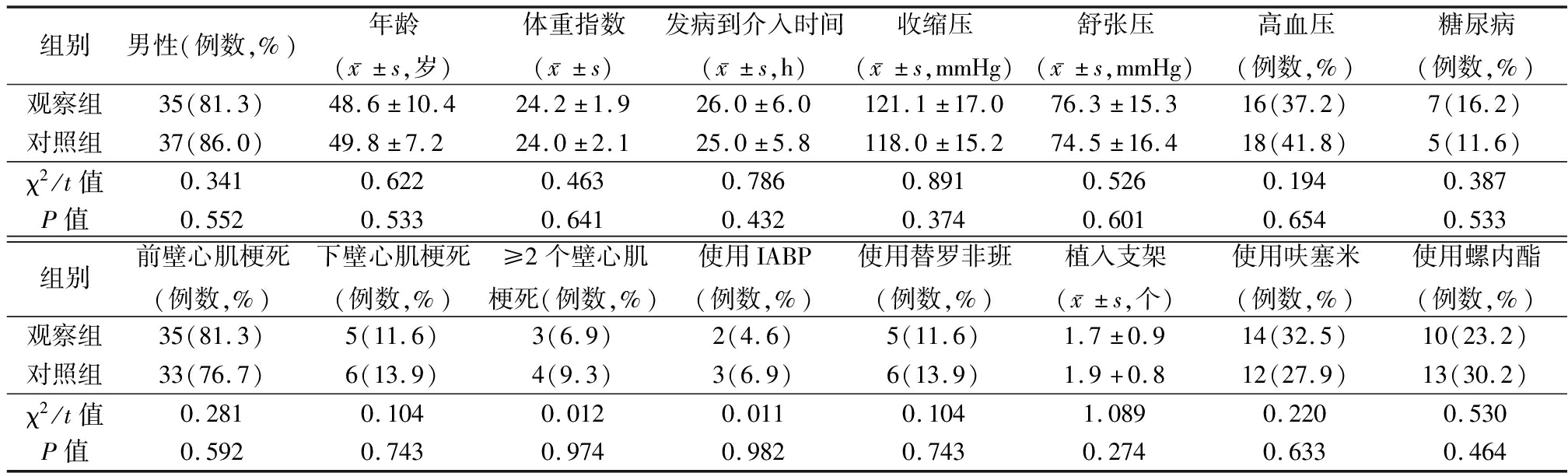
组别男性(例数,%)年龄(x-±s,岁)体重指数(x-±s)发病到介入时间(x-±s,h)收缩压(x-±s,mmHg)舒张压(x-±s,mmHg)高血压(例数,%)糖尿病(例数,%)观察组35(81.3)48.6±10.424.2±1.926.0±6.0121.1±17.076.3±15.316(37.2)7(16.2)对照组37(86.0)49.8±7.224.0±2.125.0±5.8118.0±15.274.5±16.418(41.8)5(11.6)χ2/t值0.3410.6220.4630.7860.8910.5260.1940.387P值0.5520.5330.6410.4320.3740.6010.6540.533组别前壁心肌梗死(例数,%)下壁心肌梗死(例数,%)≥2个壁心肌梗死(例数,%)使用IABP(例数,%)使用替罗非班(例数,%)植入支架(x-±s,个)使用呋塞米(例数,%)使用螺内酯(例数,%)观察组35(81.3)5(11.6)3(6.9)2(4.6)5(11.6)1.7±0.914(32.5)10(23.2)对照组33(76.7)6(13.9)4(9.3)3(6.9)6(13.9)1.9+0.812(27.9)13(30.2)χ2/t值0.2810.1040.0120.0110.1041.0890.2200.530P值0.5920.7430.9740.9820.7430.2740.6330.464
1 mmHg=0.133 kPa
1.2 方法 2组患者入院后均予以阿司匹林肠溶片及氯吡格雷片抗血小板凝集、克赛抗凝、阿托伐他汀调脂、倍他乐克缓释片降低心肌氧耗损、硝酸酯制剂等。
对照组术后予以贝那普利(北京诺华有限公司;规格10用mg;批准文号H2000029)10 mg,早晨口服1次。观察组术后予以沙库巴曲缬沙坦(诺欣妥,Novartis Pharma Schweiz AG;规格100 mg;批准文号J20190002)50 mg,2次/d,据患者耐受情况,每2~4周调整剂量,直到靶剂量200 mg,2次/d。
1.3 观察指标 ①采用飞利浦IE elite心脏彩色超声诊断仪,治疗前和治疗3个月后测定左心室收缩末期容积(left ventricular end systolic volume,LVESV)、左心室舒张末期容积(left ventricular end-diastolic volume,LVEDD)及左心室射血分数(left ventricular eject fraction,LVEF),每搏输出量(stroke volume,SV)等;②血清学生物炎症因子变化,治疗前和治疗3个月后采集空腹静脉血5 mL,分离血清,-70 ℃冰箱保存。采用酶联免疫吸附法测定血清超敏C反应蛋白(high sensitivity C-reactive protein,hs-CRP)和白细胞介素6(interleukin-6,IL-6),采用电化学发光法测定NT-proBNP;③药物不良反应,包括高钾血症、低血压及肾功能变化等,低血压是指血压低于90/60 mmHg,高钾指血钾>5.5 mmol/L,肾功能不全指肌酐>110 μmol/L;④预后及转归,再发心肌梗死、心力衰竭再住院率、发作室性心动过速或频发室性期前收缩、心源性死亡;⑤治疗3个月后进行6 min步行实验。
1.4 统计学方法 应用SPSS 22.0统计学软件分析数据。计量资料比较采用独立样本的t检验和配对t检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组心脏彩色超声指标比较 治疗前,2组LVESV、LVEDD、LVEF、SV差异无统计学意义(P>0.05);治疗后,2组LVESV、LVEDD低于治疗前,LVEF、SV高于治疗前,观察组LVESV、LVEDD低于对照组,LVEF、SV高于对照组,差异有统计学意义(P<0.05)。见表2。
表2 2组心脏彩色超声指标比较
Table 2 Comparison of the indexes of cardiac color ultrasound between two groups![]()
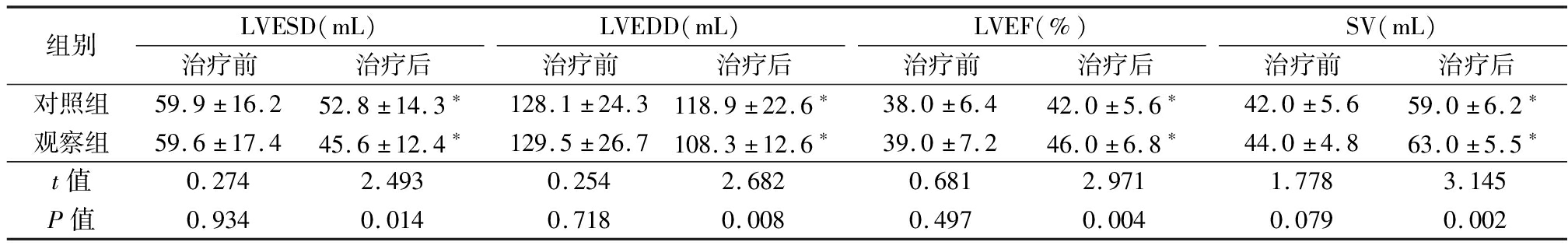
组别LVESD(mL)治疗前治疗后LVEDD(mL)治疗前治疗后LVEF(%)治疗前治疗后SV(mL)治疗前治疗后对照组59.9±16.252.8±14.3∗128.1±24.3118.9±22.6∗38.0±6.442.0±5.6∗42.0±5.659.0±6.2∗观察组59.6±17.445.6±12.4∗129.5±26.7108.3±12.6∗39.0±7.246.0±6.8∗44.0±4.863.0±5.5∗t值0.2742.4930.2542.6820.6812.9711.7783.145P值0.9340.0140.7180.0080.4970.0040.0790.002
*P值<0.05与治疗前比较(配对t检验)
2.2 2组血清炎症因子及NT-proBNP水平比较 治疗前,2组hs-CRP、IL-6、NT-proBNP水平差异无统计学意义(P>0.05);治疗后,2组hs-CRP、IL-6、NT-proBNP水平低于治疗前,观察组hs-CRP、IL-6、NT-proBNP水平低于对照组,差异有统计学意义(P<0.05)。见表3。
表3 2组血清学标志物和NT-proBNP水平比较
Table 3 Comparison of serum markers and NT-proBNP levels between two groups ![]()
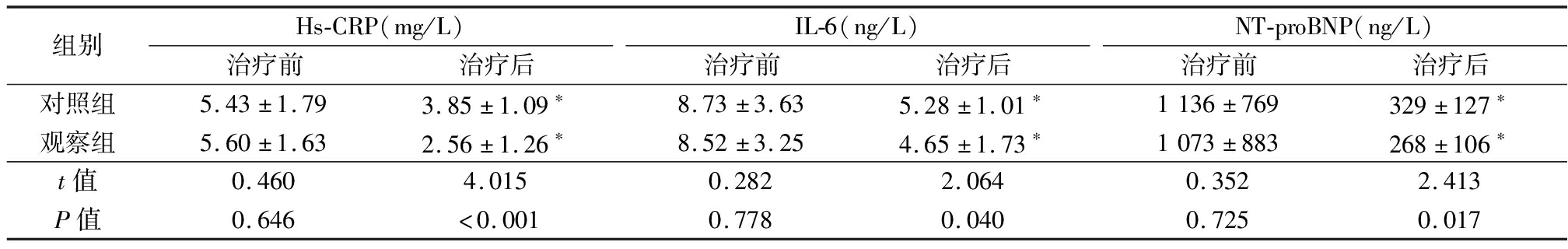
组别Hs-CRP(mg/L)治疗前治疗后IL-6(ng/L)治疗前治疗后NT-proBNP(ng/L)治疗前治疗后对照组5.43±1.793.85±1.09∗8.73±3.635.28±1.01∗1136±769329±127∗观察组5.60±1.632.56±1.26∗8.52±3.254.65±1.73∗1073±883268±106∗t值0.4604.0150.2822.0640.3522.413P值0.646<0.0010.7780.0400.7250.017
*P值<0.05与治疗前比较(配对t检验)
2.3 2组不良反应发生率比较 随访3个月,观察组发生低血压1例(2.3%)、肾功能不全2例(4.6%),对照组发生低血压2例(4.6%)、肾功能不全3例(6.9%)。2组低血压、肾功能不全不良反应发生率差异无统计学意义(χ2=0.345、0.212,P=0.557、0.645)。
2.4 2组预后转归及6 min步行实验比较 2组再发心肌梗死、室性心动过速/频发室性期前收缩、心源性猝死差异无统计学意义(P>0.05);观察组心力衰竭再住院率低于对照组,6 min步行实验长于对照组,差异有统计学意义(P<0.05)。见表4。
表4 2组预后转归及6 min步行实验比较
Table 4 Comparison of prognosis and outcome, and 6-min walking test between two groups (n=43,例数,%)
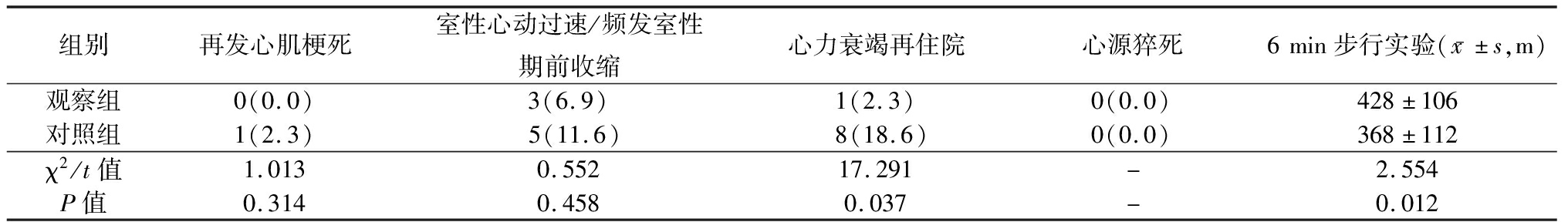
组别再发心肌梗死室性心动过速/频发室性期前收缩心力衰竭再住院心源猝死6min步行实验(x-±s,m)观察组0(0.0)3(6.9)1(2.3)0(0.0)428±106对照组1(2.3)5(11.6)8(18.6)0(0.0)368±112χ2/t值1.0130.55217.291-2.554P值0.3140.4580.037-0.012
3 讨 论
急性心肌梗死由于冠状动脉内血栓的阻塞,心肌细胞缺血缺氧,进一步发生坏死,从而导致心肌功能障碍。即便接受介入治疗,仍有30%患者出现心脏重构(心室重构是6个月时LVEDD较基线≥20%),心脏重构是发展为心肌梗死后心力衰竭的重要病理基础[4],需要对所有引起心力衰竭的危险因素进行良好管理,包括冠状动脉缺血、心律失常、血压监测、血糖控制、血脂达标等[5]。心肌缺血后,其心肌细胞和细胞外基质由于心肌缺血而发生损伤、能量缺失、神经体液失衡、纤溶系统激活、IL-6等细胞因子表达引起免疫及炎症反应,从而导致左心室重塑。心肌梗死由于冠状动脉介入治疗后,尽管区域和整体左心室功能自发恢复,但左心室重塑仍会发生,并且在较大的面积心肌梗死中尤为明显。心肌梗死后慢性心力衰竭,需要综合干预,全面管理,“金三角”治疗方案是心力衰竭的预防与治疗的主力[6]。但是,即使 “金三角”使用率近90%,难治心力衰竭患者1年内死亡、心力衰竭再住院风险仍近20%[7]。除了RAAS和交感系统,利钠肽系统在左心室重构中也发挥着重要作用[8]。而沙库巴曲缬沙坦,除抑制RAAS外,还抑制利钠肽系统,扩张血管,降低交感神经活性,发挥着利钠、利尿等作用,从而达到抑制心肌细胞肥大增生及心室重构纤维化。Langenickel等[9]研究发现,与ACEI 相比,沙库巴曲缬沙坦可显著降低心力衰竭患者心血管死亡风险、心力衰竭住院风险、全因死亡风险,显著改善症状与生活质量。本研究亦证实在心肌梗死心力衰竭患者中,对比贝那普利,沙库巴曲缬沙坦改善左心室心功能更加明显,增加患者活动耐量,而不增加其不良反应及心血管事件,因此,在标准有优化药物治疗基础上,早期使用沙库巴曲缬沙坦可能使急性心肌梗死后心力衰竭患者获益更大。
血浆NT-proBNP水平由于心肌损伤而引起心室压力增加。但是,对其许多心力衰竭以外的疾病(如感染、炎症性肺部疾病、癌症等)也会导致其升高。NT-proBNP已被证实可预测心力衰竭患者的不良预后[10]。尽管有活性BNP在心力衰竭发作期间对心脏产生保护作用,但BNP或NT-proBNP的循环水平反映不稳定血液动力学及神经激素激活[11]。体内缺乏有活性BNP可促进心力衰竭的发作[12],而使用重组BNP或脑啡肽酶抑制剂可增强BNP的效果有助于改善及预防心力衰竭发作[13]。本研究随访3个月,观察组NT-proBNP水平下降更为明显,活动耐量改善。
心力衰竭发生时是一种全身性炎症反应综合征[14],随着疾病的进展,心力衰竭患者循环中的炎症生物标志物水平升高[15]。心力衰竭患者的全身性炎症可能由组织灌注不足和神经激素激活引起,Buckley等[16]研究表明,促炎状态可能有助于心力衰竭的发生和发展,这种炎症状态不仅影响心肌本身功能,还会导致其他器官和组织功能障碍,从而带来心力衰竭患者其他方面的并发症,包括恶病质和贫血[15]。心力衰竭患者hs-CRP、IL-6水平升高[17],并随着心力衰竭失代偿而增加,可能导致更不好的结局。升高的hs-CRP、IL-6水平反映了心力衰竭中的炎症和免疫失调[18],并与缺血性心脏病心功能恶化和活动耐量下降密切有关[19-20]。本研究结果显示,如果在心肌梗死后心力衰竭早期使用沙库巴曲/缬沙坦治疗,3个月后hs-CRP、IL-6水平降低。既往研究证实,在使用沙库巴曲缬沙坦治疗后,全身炎症反应也会减轻[21-22]。然而,尚无临床实践中对此进行评估,因此,早期应用沙库巴曲缬沙坦抑制炎症反应有利于改善心力衰竭患者预后。
综上所述,急性心肌梗死后心力衰竭患者早期使用沙库巴曲缬沙坦疗效更佳,在抗炎、改善左心室重塑等方面更具优势,同时不增加不良反应及心血管事件发生率。但需注意的是,本研究纳入例数较少,可能研究结果存在误差,故其疗效及预后还需要进一步论证。
[1] Kaul P,Ezekowitz JA,Armstrong PW,et al.Incidence of heart failure and mortality after acute coronary syndromes[J].Am Heart J,2013,165(3):379-385.
[2] Qureshi WT,Zhang ZM,Chang PP,et al.Silent myocardial infarction and long-term risk of heart failure:the ARIC study[J].J Am Coll Cardiol,2018,71(1):1-8.
[3] Rodrigues G,Tralhao A,Aguiar C,et al.Is the PARADIGM-HF cohort representative of the real-world heart failure patient population?[J].Rev Port Cardiol,2018,37(6):491-496.
[4] Abrahamsson P,Dobson J,Granger CB,et al.Impact of hospitalization for acute coronary events on subsequent mortality in patients with chronic heart failure[J].Eur Heart J,2009,30(3):338-345.
[5] 中华医学会心血管病学分会心力衰竭学组,中国医师协会心力衰竭专业委员会,中华心血管病杂志编辑委员会.中国心力衰竭诊断和治疗指南2018[J].中华心血管病杂志,2018,46(10):760-789.
[6] Galli A,Lombardi F.Postinfarct left ventricular remodelling:a prevailing cause of heart failure[J].Cardiol Res Pract,2016,2016:2579832.
[7] Chioncel O,Lainscak M,Seferovic PM,et al.Epidemiology and one-year outcomes in patients with chronic heart failure and preserved,mid-range and reduced ejection fraction:an analysis of the ESC heart failure long-term registry[J].Eur J Heart Fail,2017,19(12):1574-1585.
[8] McMurray JJ,Adamopoulos S,Anker SD,et al.ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012:the task force for the diagnosis and treatment of acute and chronic heart failure 2012 of the european society of cardiology.Developed in collaboration with the heart failure association(HFA)of the ESC[J].Eur J Heart Fail,2012,14(8):803-869.
[9] Langenickel TH,Jordaan P,Petruck J,et al.Single therapeutic and supratherapeutic doses of sacubitril/valsartan(LCZ696)do not affect cardiac repolarization[J].Eur J Clin Pharmacol,2016,72(8):917-924.
[10] de Lemos JA,McGuire DK,Drazner MH.B-type natriuretic peptide in cardiovascular disease[J].Lancet,2003,362(9380):316-322.
[11] Arzilli C,Aimo A,Vergaro G,et al.N-terminal fraction of pro-B-type natriuretic peptide versus clinical risk scores for prognostic stratification in chronic systolic heart failure[J].Eur J Prev Cardiol,2018,25(8):889-895.
[12] Tamura N,Ogawa Y,Chusho H,et al.Cardiac fibrosis in mice lacking brain natriuretic peptide[J].Proc Natl Acad Sci U S A,2000,97(8):4239-4244.
[13] Gong X,Mou Z,Shao L,et al.Human recombinant-B-type natriuretic peptide protect ventricular function and structure in ST-elevation myocardial infarction[J].Int J Clin Exp Pathol,2015,8(9):11622-11628.
[14] van Linthout S,Tschope C.Inflammation-cause or consequence of heart failure or both?[J].Curr Heart Fail Rep,2017,14(4):251-265.
[15] Buckley LF,Abbate A.Interleukin-1 blockade in cardiovascular diseases:from bench to bedside[J].Bio Drugs,2018,32(2):111-118.
[16] Buckley LF,Abbate A.Interleukin-1 blockade in cardiovascular diseases:a clinical update[J].Eur Heart J,2018,39(22):2063-2069.
[17] Shao T,Zhang Y,Tang R,et al.Effects of milrinone on serum IL-6,TNF-alpha,Cys-C and cardiac functions of patients with chronic heart failure[J].Exp Ther Med,2018,16(5):4162-4166.
[18] van Tassell BW,Arena RA,Toldo S,et al.Enhanced interleukin-1 activity contributes to exercise intolerance in patients with systolic heart failure[J].PLoS One,2012,7(3):e33438.
[19] Kittel-Schneider S,Kaspar M,Berliner D,et al.CRP genetic variants are associated with mortality and depressive symptoms in chronic heart failure patients[J].Brain Behav Immun,2018,71:133-141.
[20] Eskandari V,Amirzargar AA,Mahmoudi MJ,et al.Gene expression and levels of IL-6 and TNF-alpha in PBMCs correlate with severity and functional class in patients with chronic heart failure[J].Ir J Med Sci,2018,187(2):359-368.
[21] Jing W,Vaziri ND,Nunes A,et al.LCZ696(Sacubitril/valsartan)ameliorates oxidative stress,inflammation,fibrosis and improves renal function beyond angiotensin receptor blockade in CKD[J].Am J Transl Res,2017,9(12):5473-5484.
[22] Zhang H,Liu G,Zhou W,et al.Neprilysin inhibitor-angiotensin Ⅱ receptor blocker combination therapy(sacubitril/valsartan)suppresses atherosclerotic plaque formation and inhibits inflammation in apolipoprotein E-deficient mice[J].Sci Rep,2019,9(1):6509.