百草枯是高效、季胺类除草剂。我国是一个农业大国,百草枯在我国广泛应用,因此中毒患者数量也呈逐年上升趋势。百草枯进入体内,造成多器官功能衰竭,病情危重,主要损伤肺、肝、肾等重要脏器,患者病死率高,而且无特效解毒药物[1]。目前百草枯中毒的病理过程还不十分清楚,虽然前期研究取得一些进展,但其分子机制尚未阐明。已有研究表明,百草枯中毒所导致的脏器损伤与激活的炎性细胞因子白细胞介素8(interleukin-8,IL-8)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)以及T淋巴细胞亚群CD3+、CD4+、CD8+和CD4+/CD8+免疫调节紊乱紧密相关[2]。乌司他丁是从尿中提取的一种糖蛋白,在新近的研究中发现,它具有抑制蛋白酶的活性、抗氧化、阻止炎性细胞因子的释放等作用[3]。本研究选取邯郸市中心医院急诊科收治的急性口服百草枯中毒患者80例作为研究对象,探讨乌司他丁治疗百草枯患者的临床疗效以及对炎性细胞因子和T淋巴细胞亚群的影响,为临床提高救治率、降低病死率提供理论参考。现将研究成果报告如下。
1 资料与方法
1.1 一般资料 选取2014年1月—2019年12月邯郸市中心医院收治的百草枯中毒患者80例,均符合《急性百草枯中毒诊治专家共识(2013)》诊断标准[4],所有患者年龄大于18岁,都是口服中毒,服毒量为5~100 mL,患者的血和尿中均检测出百草枯成分,从服毒到来医院就诊时间小于6 h。排除标准:既往有严重的基础疾病,如心、脑血管系统疾病、肝、肾功能障碍,严重贫血,恶性肿瘤,生活不能自理者。患者签属知情同意书,自愿参加该实验。将纳入研究的患者按照就诊先后顺序分为对照组40例、治疗组40例进行临床指标比较,在两组中能够存活14 d的患者(对照组21例,治疗组30例)再进行血液生化、炎性细胞因子、T巴细胞亚群的比较。对照组:男性14例,女性26例,年龄20~69岁,平均(46.50±5.53)岁;治疗组:男性16例,女性24例,年龄25~63岁,平均(44.46±5.61)岁。2组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
本研究获得邯郸市中心医院医学伦理委员会批准。
1.2 治疗方法 2组患者就诊后均给予基础治疗。①阻止毒物吸收:立即给予清水洗胃,大约需要5 L以上,直至洗胃液清亮。之后20%甘露醇250 mL、硫酸镁粉40 g口服导泻,活性炭100 g分次口服;②血液净化治疗:12 h/次,共进行6次。每次治疗包括2 h血液灌流(HA-330灌流器由健帆生物科技公司提供)和4 h血液透析;③抑制炎症反应:激素甲泼尼龙10~15 mg·kg-1·d-1联合免疫抑制剂环磷酰胺5~10 mg·kg-1·d-1冲击,依据病情逐渐减量。④积极抗氧化治疗:口服褪黑素、维生素E,静脉应用谷胱甘肽、大量维生素C、氨溴索、丹参等⑤其他辅助治疗:普萘洛尔、当归、川芎、连翘等。口腔及食道有灼伤的患者口服康复新液、金因肽,对于频繁呕吐的给予胃复安、质子泵抑制剂等治疗,重症中毒患者,往往有合并症存在,还应积极预防感染。
治疗组在上述治疗的基础上,加用乌司他丁(又名:天普洛安,广东天普生化医药有限公司生产,批准文号:国药准字H20045327,规格:10万U/支)治疗,30万U/次,2次/d静脉滴注,疗程14 d。
1.3 观察指标
1.3.1 临床指标 观察14 d 2组患者急性肺损伤(acute lung injury,ALI)/呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的发生率(%)、ICU住院时间(d)、存活率(%)、死亡患者存活时间(d)。
1.3.2 血液生化及炎性因子指标 2组患者在治疗前、治疗7 d、治疗14 d从肘静脉抽取血液10 mL,在4 ℃条件下高速(4 000 r/min)离心20 min,提取上清液,保存于日本三洋株式会社生产的超低温冰箱(-80 ℃)待检。采用日本东芝TOSHIBA-40FR全自动生化分析仪检测肝肾功能指标丙氨酸转氨酶(alanine aminotransferase,ALT),天冬氨酸转氨酶(aspartate aminotransferase,AST),尿素氮(blood urea nitrogen,BUN),肌酐(creatinine,Cr)。采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测血液中IL-8、TNF-α、MMP-9的含量,试剂盒由武汉博士德公司提供,操作步骤(包被、洗涤、封闭、加入一抗、二抗、显色)严格按照说明书进行,采用西班牙Cri-Tzw kEnzyme荧光酶标仪测量450 nm光波处标本的OD值。根据吸光度值的标准曲线,计算IL-8、TNF-α、MMP-9的含量。
1.3.3 T淋巴细胞亚群检测 采用SAP酶标法检测2组患者治疗前、治疗7 d、治疗14 d的血液中T淋巴细胞亚群CD3+、CD4+、CD8+和CD4+/CD8+百分比。在血液标本中加入一抗工作液,在室温孵育20 min,用PBS液进行反复冲洗,加入生物素标记的二抗S-A/AP试剂盒(由美国ZYMED公司生产),然后加入碱磷酶标记的链霉卵白素形成复合物,最后滴入显色剂,借助碱磷酶使底物显色。使用默赛飞EVOS M7000显微成像系统观察带有红色标记的阳性细胞,计算出阳性细胞百分比。
1.4 统计学方法 应用SPSS 22.0统计软件分析数据。计数资料采用χ2检验;计量资料采用独立样本t检验和重复测量的方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 2组患者临床指标比较 治疗组患者ALI/ARDS的发生率、ICU的住院时间显著低于对照组,差异有统计学意义(P<0.05);治疗组的存活例数和死亡患者存活时间显著高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 2组临床指标比较
Table 1 Comparison of clinical indicators between two groups ![]()
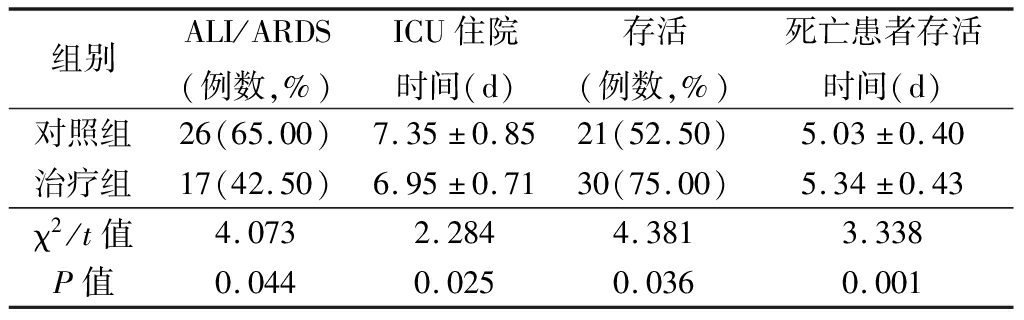
组别ALI/ARDS(例数,%)ICU住院时间(d)存活(例数,%)死亡患者存活时间(d)对照组26(65.00)7.35±0.8521(52.50)5.03±0.40治疗组17(42.50)6.95±0.7130(75.00)5.34±0.43χ2/t值4.0732.2844.3813.338P值0.0440.0250.0360.001
2.2 2组患者血液生化指标比较 在治疗后,2组患者ALT、AST、BUN、Cr均有不同程度的下降,2组在组间、时点间、组间·时点间交互作差异均有统计学意义(P<0.01)。见表2。
表2 2组血液生化指标比较
Table 2 Comparison of blood biochemical indexes between two groups ![]()
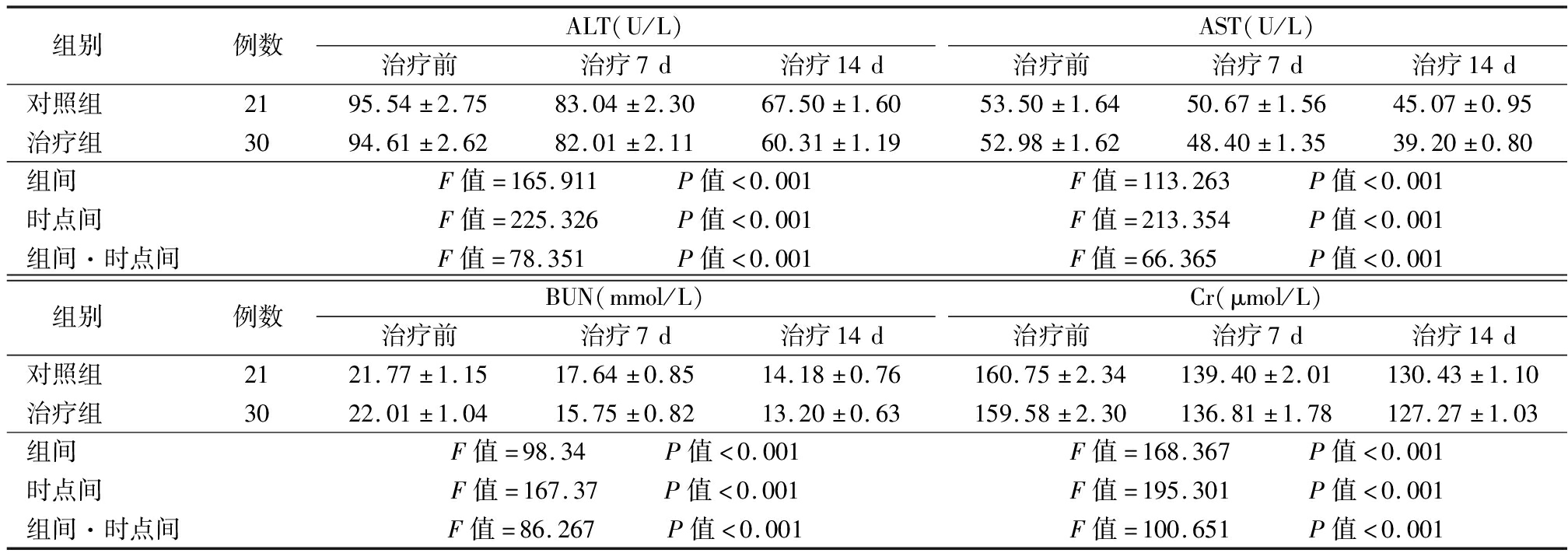
组别 例数ALT(U/L)治疗前治疗7d治疗14dAST(U/L)治疗前治疗7d治疗14d对照组 2195.54±2.7583.04±2.3067.50±1.6053.50±1.6450.67±1.5645.07±0.95治疗组 3094.61±2.6282.01±2.1160.31±1.1952.98±1.6248.40±1.3539.20±0.80组间 F值=165.911 P值<0.001F值=113.263 P值<0.001时点间 F值=225.326 P值<0.001F值=213.354 P值<0.001组间·时点间F值=78.351 P值<0.001F值=66.365 P值<0.001组别 例数BUN(mmol/L)治疗前治疗7d治疗14dCr(μmol/L)治疗前治疗7d治疗14d对照组 2121.77±1.1517.64±0.8514.18±0.76160.75±2.34139.40±2.01130.43±1.10治疗组 3022.01±1.0415.75±0.8213.20±0.63159.58±2.30136.81±1.78127.27±1.03组间 F值=98.34 P值<0.001F值=168.367 P值<0.001时点间 F值=167.37 P值<0.001F值=195.301 P值<0.001组间·时点间F值=86.267 P值<0.001F值=100.651 P值<0.001
2.3 TNF-α、MMP-9含量的变化 经乌司他丁治疗后,2组患者中IL-8、TNF-α、MMP-9的含量均降低,2组在组间、时点间、组间·时点间交互作差异均有统计学意义。见表3。
表3 2组患者炎性细胞因子含量比较
Table 3 Comparison of inflammatory cytokine level between two groups![]()
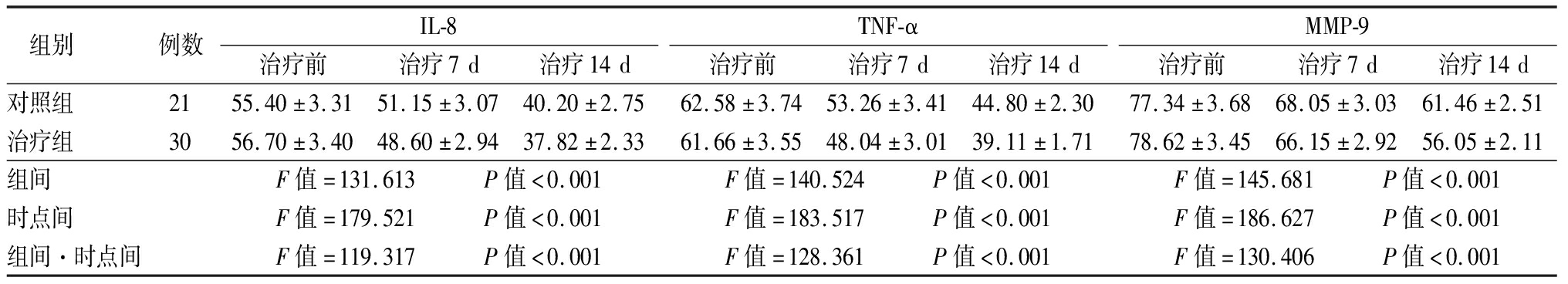
组别 例数IL-8治疗前治疗7d治疗14dTNF-α治疗前治疗7d治疗14dMMP-9治疗前治疗7d治疗14d对照组 2155.40±3.3151.15±3.0740.20±2.7562.58±3.7453.26±3.4144.80±2.3077.34±3.6868.05±3.0361.46±2.51治疗组 3056.70±3.4048.60±2.9437.82±2.3361.66±3.5548.04±3.0139.11±1.7178.62±3.4566.15±2.9256.05±2.11组间 F值=131.613 P值<0.001F值=140.524 P值<0.001F值=145.681 P值<0.001时点间 F值=179.521 P值<0.001F值=183.517 P值<0.001F值=186.627 P值<0.001组间·时点间F值=119.317 P值<0.001F值=128.361 P值<0.001F值=130.406 P值<0.001
2.4 两组患者血液中T淋巴细胞亚群比较 治疗后,外周血T淋巴细胞亚群CD3+、CD4+、CD4+/CD8+含量较治疗前升高(P<0.05),CD8+含量反而下降(P<0.05);与对照组比较,治疗组在应用乌司他丁治疗后,CD3+、CD4+、CD4+/CD8+升高更加显著(P<0.05),CD8+含量下降更为明显(P<0.05)。2组在组间、时点间、组间·时点间交互作差异均有统计学意义。见表4。
表4 两组患者血液中T淋巴细胞亚群水平比较
Table 4 Comparison of the level of blood T lymphocyte subsets between two groups![]()
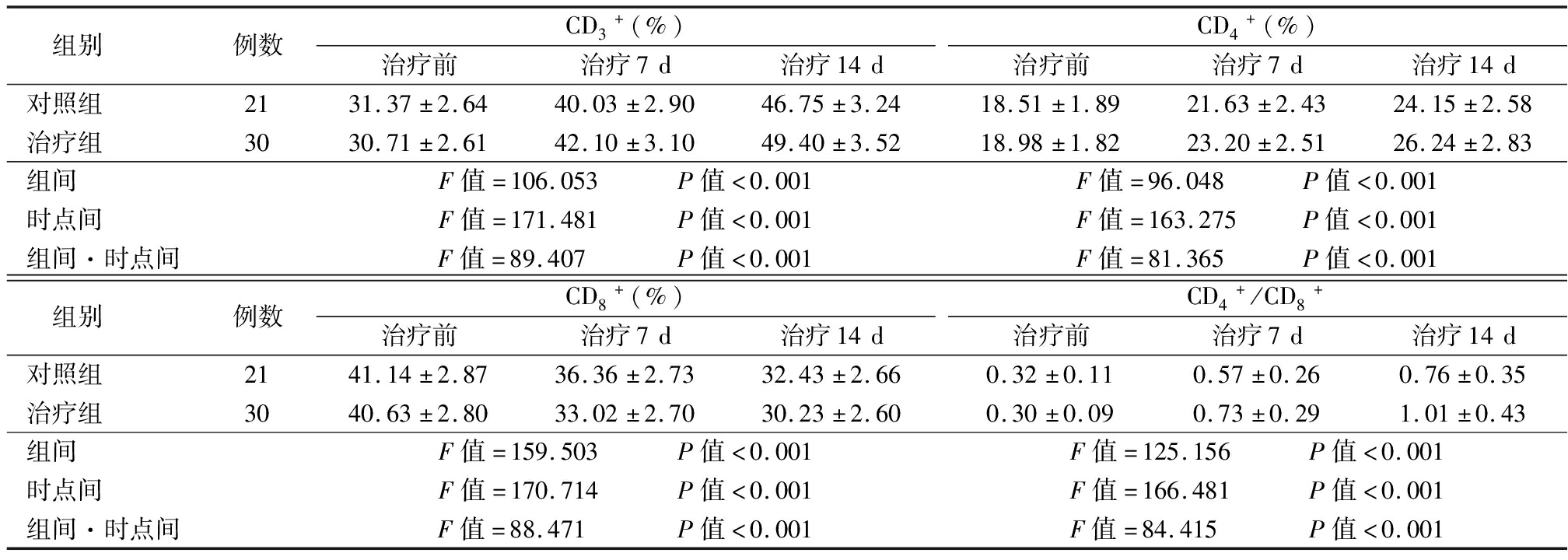
组别 例数CD3+(%)治疗前治疗7d治疗14dCD4+(%)治疗前治疗7d治疗14d对照组 2131.37±2.6440.03±2.9046.75±3.2418.51±1.8921.63±2.4324.15±2.58治疗组 3030.71±2.6142.10±3.1049.40±3.5218.98±1.8223.20±2.5126.24±2.83组间 F值=106.053 P值<0.001F值=96.048 P值<0.001时点间 F值=171.481 P值<0.001F值=163.275 P值<0.001组间·时点间F值=89.407 P值<0.001F值=81.365 P值<0.001组别 例数CD8+(%)治疗前治疗7d治疗14dCD4+/CD8+治疗前治疗7d治疗14d对照组 2141.14±2.8736.36±2.7332.43±2.660.32±0.110.57±0.260.76±0.35治疗组 3040.63±2.8033.02±2.7030.23±2.600.30±0.090.73±0.291.01±0.43组间 F值=159.503 P值<0.001F值=125.156 P值<0.001时点间 F值=170.714 P值<0.001F值=166.481 P值<0.001组间·时点间F值=88.471 P值<0.001F值=84.415 P值<0.001
3 讨 论
近年来,许多研究发现脏器损伤与炎症反应导致的免疫紊乱息息相关,因此,在探讨百草枯中毒病理过程中,炎症反应及其免疫紊乱成为人们研究的热点问题。百草枯可以经皮肤、呼吸道、口服等多种途径导致中毒,但口服是主要途径。基础研究和动物实验均表明,进入体内的百草枯作为电子载体,与氧结合生成有活性的超氧阴离子,在过氧化物歧化酶的作用下进一步生成H2O2,H2O2经过氧化还原反应生成高活性的氧自由基,从而诱导机体产生级联放大的炎症反应并释放大量炎性细胞因子,导致免疫功能紊乱,引起细胞损伤、凋亡,破坏脏器功能[5]。乌司他丁是从尿液中提取的一种蛋白酶抑制剂,相对分子质量6 700 000,143个氨基酸组成,它对纤溶酶、α-糜蛋白酶、丝氨酸酶、胰蛋白酶等多种酶有抑制作用,同时还可以稳定溶酶体膜,阻止溶酶体酶的活化,减少炎性细胞如中性粒细胞、淋巴细胞等的聚集,清除氧自由基、抑制炎性介质的释放,调节免疫功能[6]。我国虽然已经对百草枯中毒进行了深入的研究,但乌司他丁对其的治疗暂无确切的临床结论。本研究将乌司他丁注射液用于百草枯的治疗,明显降低了中毒患者ALL/ARDS的发生率,提高了存活率,缩短了在ICU内的住院时间,延长了死亡患者的存活时间,血液生化指标ALT、AST、Cr、BUN也明显下降,改善了中毒患者的临床及生化指标。
研究表明,炎症反应及其产生的细胞因子在百草枯中毒病理过程中起着极其重要的作用[7]。炎性细胞因子IL-8是由上皮细胞和巨噬细胞产生的[8]。在炎症反应中具有很强的趋化作用,它可以趋化并激活中性粒细胞、T淋巴细胞等炎性细胞,这些被激活的炎性细胞进一步合成和释放TNF-α、MMP-9等多种炎性细胞因子,参与炎症反应,导致组织细胞功能和结构的损伤[9]。TNF-α作为炎症反应的早期细胞因子,促使各种免疫应答和炎性反应,它主要由活化的巨噬细胞、单核细胞、B淋巴细胞及T淋巴细胞产生[10]。具有启动、调节炎症反应的作用。目前研究证明,在血管表皮细胞、中性粒细胞、内皮细胞、腹腔间皮细胞等多种细胞表面存在TNF-α受体,当TNF-α与受体结合后,促使细胞产生和分泌MMP-9、IL-1、IL-6、IL-8等细胞因子,起到放大炎症反应的效应。基质金属蛋白酶MMP-9是一种糖蛋白,又称为明胶酶B,它是由单核细胞、中性粒细胞、巨噬细胞等细胞分泌的,以胶原蛋白、弹性蛋白、Ⅳ型胶原为底物,降解细胞外基质成分,破坏组织结构[11]。IL-8、TNF-α、MMP-9在炎症反应中相互协同、相互辅助,形成正反馈效应。实验证明,MMP-9基因序列的启动子存在TNF-α的结合位点,TNF-α与之结合,促进MMP-9的基因表达,当该结合位点被阻断后,TNF-α上调MMP-9的作用也被抑制[12]。MMP-9不仅接受TNF-α、IL-8的调节,还可以协助相关转化酶,使TNF-α的前体转化为有活性的TNF-α。另外,MMP-9还通过裂解IL-8氨基末端特异位点,使IL-8趋化活性较原来增加30倍。已有研究表明,许多疾病的病理学改变如脓毒症、多脏器功能衰竭、急性呼吸窘迫综合征与炎性细胞因子IL-8、TNF-α、MMP-9水平增高密切相关[13]。本研究结果显示,在百草枯中毒治疗前的各个时间点,血浆中炎性细胞因子IL-8、TNF-α、MMP-9含量均呈高水平表达,提示在百草枯中毒中,IL-8、TNF-α、MMP-9起重要作用,经过乌司他丁治疗后,IL-8、TNF-α、MMP-9均有不同程度的下降,与治疗前比较差异有统计学意义(P<0.05),说明乌司他丁能够抑制百草枯中毒导致的炎症反应,减少炎性细胞因子的产生,对百草枯中毒的救治有积极的作用。
近期研究发展,多种疾病的发生、发展与机体的免疫功能紊乱密切相关[14]。T淋巴细胞亚群是反映机体免疫功能状态和平衡情况的重要指标。在众多实验中发现,通过对T淋巴细胞亚群CD3+、CD4+、CD8+的分析,可以判断疾病严重程度[15]。CD3+是免疫系统中最为重要的组成部份,它既参与细胞免疫,又调控体液免疫。CD4+属于辅助/诱导性T淋巴细胞,通过调节TNF-β、IL-2、IFN-γ细胞因子和IL-4、5、6、10的分泌辅助B淋巴细胞产生抗体,从而调控体液免疫。CD8+属于抑制/细胞毒性T淋巴细胞,能够识别靶细胞,诱导靶细胞溶解凋亡。正常状态下,T淋巴细胞每个亚群的数量处于动态平衡,它们之间既互相协作又相互制约,维持机体免疫功能的稳定[16]。当机体出现病理改变时,T淋巴细胞总数CD3+、CD4+、CD8+以及它们的比值发生变化,免疫功能受损,调节发生紊乱。因此,观察T淋巴细胞亚群数目的变化,成为研究百草枯中毒患者免疫功能的简便可靠方法。本研究结果显示,在百草枯中毒后CD3+、CD4+、CD4+/CD8+比值均降低,CD8+含量增高,提示T淋巴细胞功能处于紊乱状态,机体免疫受到抑制。在应用乌司他丁治疗后,治疗组患者的CD3+、CD4+、CD4+/CD8+比值均升高,CD8+含量降低,与对照组比较差异有统计学意义,说明乌司他丁可以纠正百草枯中毒患者T淋巴细胞亚群失调的状态,改善组织细胞免疫功能紊乱,调节免疫细胞活性,提高机体免疫力。因此,乌司他丁对机体T淋巴细胞的免疫调节作用可以为百草枯中毒治疗提供新的思路。
综上所述,通过研究乌司他丁对百草枯中毒患者炎性细胞因子及T淋巴细胞亚群的影响,不仅阐明了百草枯中毒的病理机制,而且也为乌司他丁治疗百草枯中毒奠定了理论基础。实验表明,乌司他丁抑制了炎性因子的释放,调节了机体的免疫功能,改善了中毒患者内环境的平衡状态,对百草枯中毒的治疗发挥了积极的作用,值得推广。
[1] 张芮嘉,关晓辉.百草枯中毒的诊治进展[J].中国老年保健医学,2020,18(1):98-100.
[2] 王鑫,李爱军,李伟哲,等.血必净对急性百草枯中毒大鼠肺损伤细胞凋亡及炎性因子的影响[J].中华劳动卫生职业病杂志,2018,36(7):551-555.
[3] Lun MH,Jin XY,Wang MY,et al.Ulinastatin improves myocardial ischemia-reperfusion injury in rats through endoplasmic reticulum stress-induced apoptosis pathway[J].Eur Rev Med Pharmacol Sci,2020,24(10):5742-5749.
[4] 中国医师协会急诊医师分会.急性百草枯中毒诊治专家共识(2013)[J].中国急救医学,2013,33(6):484-489.
[5] Gao L,Yuan H,Xu E,et al.Toxicology of paraquat and pharmacology of the protective effect of 5-hydroxy-1-methylhydantoin on lung injury caused by paraquat based on metabolomics[J].Sci Rep,2020,10(1):1790.
[6] Qi AL,Wu Y,Dong N,et al.Recombinant human ulinastatin improves immune dysfunction of dendritic cells in septic mice by inhibiting endoplasmic reticulum stress-related apoptosis[J].Int Immunopharmacol,2020,85:106643.
[7] Gao YX,Hou LL,Wang YB,et al.Octreotide alleviates pancreatic damage caused by paraquat in rats by reducing inflammatory responses and oxidative stress[J].Environ Toxicol Pharmacol,2020,80(11):103456.
[8] Casasanta MA,Yoo CC,Udayasuryan B,et al.Fusobacterium nucleatum host-cell binding and invasion induces IL-8 and CXCL1 secretion that drives colorectal cancer cell migration[J].Sci Signal,2020,13(641):9157.
[9] Hao G,Duan W,Sun J,et al.Effects of febuxostat on serum cytokines IL-1,IL-4,IL-6,IL-8,TNF-α and COX-2[J].Exp Ther Med,2019,17(1):812-816.
[10] Chen XJ,Zhang JG,Wu L.Plumbagin inhibits neuronal apoptosis,intimal hyperplasia and also suppresses TNF-α/NF-κB pathway induced inflammation and matrix metalloproteinase-2/9 expression in rat cerebral ischemia[J].Saudi J Biol Sci,2018,25(6):1033-1039.
[11] Lee GH,Jin SW,Kim SJ,et al.Tetrabromobisphenol a induces MMP-9 expression via NADPH oxidase and the activation of ROS,MAPK,and Akt pathways in human breast cancer MCF-7 cells[J].Toxicol Res,2019,35(1):93-101.
[12] 叶玲,林小妹.金匮肾气丸联合玉屏风散补肾益气对慢阻肺大鼠IL-8、TNF-α、MMP-9、P-P65和IKB-α的影响[J].中国免疫学杂志,2019,35(15):1835-1839.
[13] 许乐宜,孔令军,龚立,等.鼠神经生长因子治疗老年脑出血临床疗效及对患者血清NSE、hs-CRP、TNF-α、IL-8、MMP-9影响[J].脑与神经疾病杂志,2019,27(4):242-246.
[14] Chraa D,Naim A,Olive D,et al.T lymphocyte subsets in cancer immunity:Friends or foes[J].J Leukoc Biol,2019,105(2):243-255.
[15] Lu Y,An L,Liu Q,et al.Expression and clinical correlations of costimulatory molecules on peripheral T lymphocyte subsets of early-stage severe sepsis:a prospective observational study[J].Shock,2018,49(6):631-640.
[16] Feng HX,Cheng Y,Zhu W,et al.T-lymphocyte subsets as a predictive biomarker for stroke-associated pneumonia[J].Am J Transl Res,2018,10(12):4367-4375.