宫颈癌(cervical cancer,CC)是女性常见的恶性肿瘤之一[1]。近年来,CC的发病率逐年上升,且呈年轻化趋势[2-3]。CC的复发转移是造成死亡的重要原因之一。在肿瘤转移过程中,癌细胞从原发灶分离后到达血液,成为循环肿瘤细胞(circulating tumor cell,CTC),可靶向远处器官并有助于继发性肿瘤的发生[4]。与计算机断层和正电子发射断层扫描相比,CTC检测有助于更早、更有效地诊断肿瘤的复发和转移[5]。循环肿瘤微栓(circulating tumor microemboli,CTM)即两个或以上CTC集群,有利于细胞之间的生物信息传递,更容易在血流剪切压力下存活[6],导致肿瘤复发或远端转移。目前关于CTC/CTM在CC癌患者中临床意义的研究甚少,本文旨在探究CTC/CTM在CC癌患者中的分布及与临床特征和血清肿瘤标志物表达水平之间的关系。
1 资料与方法
1.1 一般资料 纳入2016年4月—2020年4月上海交通大学医学院附属苏州九龙医院收治的拟进行手术的初治患者32例,术后病理诊断为宫颈癌。纳入标准:未经过放疗、化疗和激素治疗。排除第二原发肿瘤患者、妊娠和哺乳期患者、合并自身免疫疾病患者、严重肝肾不全患者。年龄28~65岁,平均(48.41±5.51)岁;鳞癌25例,腺癌6例,其他1例;术后肿瘤病理分期及分级分别参照WHO分级标准和国际妇产科联盟推荐标准[7-8]:Ⅰ期6例、Ⅱ期11例、Ⅲ期6例、Ⅳ期9例。
本研究经医院医学伦理委员会批准通过,所有受试者均自愿签订知情同意书。
1.2 方法
1.2.1 病理资料 收集32例患者的年龄、病理类型、临床分期和病理分级、淋巴结转移情况。同时记录采血时1周内血清CA125、CA199和SCC-Ag的表达水平。
1.2.2 CTC和CTM检测方法 CTC检测试剂盒购于江苏莱尔生物医药科技有限公司,其试剂盒具体包括人外周血白细胞去除试剂盒(抗人CD45荧光免疫抗体染色试剂,抗人EpCAM的荧光免疫抗体染色试剂)和8号染色体着丝粒荧光原位杂交样品处理试剂盒。
采集肘静脉血4 mL于ACD抗凝的黄色采血管中,避光低温保存,24 h内检测。应用红细胞裂解法除去红细胞,磁珠抗体除去白细胞,应用免疫荧光技术染色肿瘤标志物,再利用荧光原位杂交技术标记8号染色体。上述实验操作完成后在荧光显微镜下观察。先将显微物镜镜头调至×10,然后按照读片规则依次读片,在不同视野过程中发现CD45阴性细胞,确定8号染色体的数目后,再依次自动调至蓝光、绿光下镜下观察。CTC的判读标准为EpCAM+/CD45-/DAPI+/CEP8≥2或者EpCAM-/CD45-/DAPI+/CEP8≥2;CTM的判读标准为单个循环肿瘤细胞数量≥2个CTC聚集成的细胞团。
1.2.3 血清标志物CA125、CA199和SCC-Ag检测方法 采集空腹肘静脉血3 mL,静置离心后分上层血清,应用电化学发光免疫分析技术检测CA125、CA199和SCC-Ag的表达水平(罗氏Cobas e601型全自动电化学发光免疫分析系统及配套试剂)。血清标志物检测的判定结果参考配套试剂的说明书,CA125≥35 kU/L为阳性,CA199≥35 kU/L为阳性,SCC-Ag≥1.5 μg/L为阳性。
1.3 统计学方法 应用SPSS 26.0统计软件分析数据。计数资料比较采用χ2检验,相关性分析采用Pearson检验。P<0.05为差异有统计学意义。
2 结 果
2.1 宫颈癌患者外周血中CTC/CTM各亚型的分布情况 收集32例宫颈癌患者的外周血,荧光显微镜下观察CTC/CTM(图1)。32例检出CTC阳性29例,阳性检出率为90.63%;检出CTM阳性9例,阳性检出率为28.13%。
29例CTC阳性宫颈癌患者中检出三倍体CTC 19例,三倍体阳性检出率为59.40%,检出范围为0~7个/4 mL,检出个数为(1.50±1.90)个;检出四倍体CTC 16例,四倍体阳性检出率为55.10%,检出范围为0~5个/4 mL,检出个数为(0.97±1.31)个;检出多倍体CTC 22例,多倍体阳性检出率为68.80%,检出范围为0~7个/4 mL,检出个数为(1.78±1.93)个。
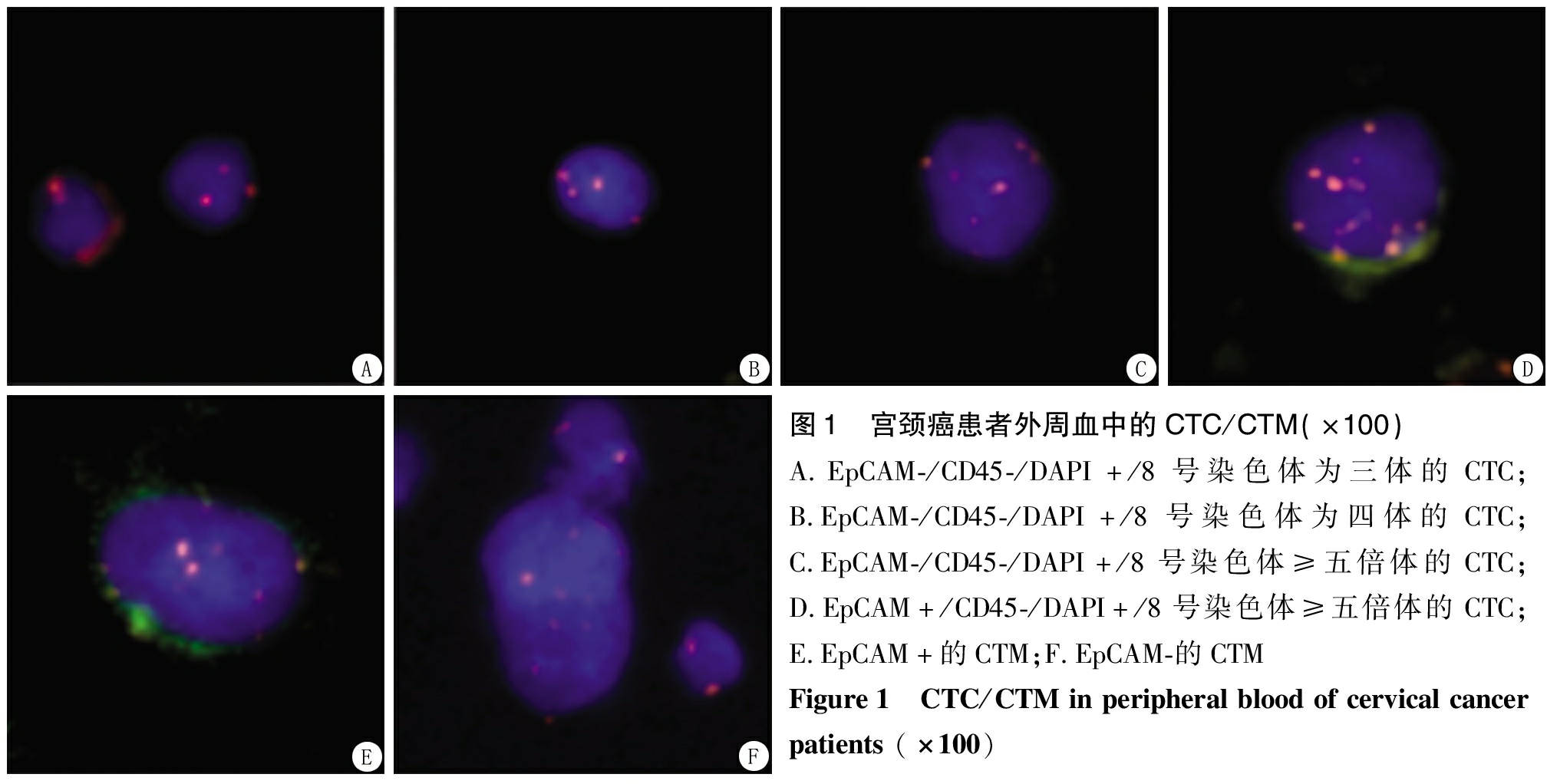
图1 宫颈癌患者外周血中的CTC/CTM(×100)A.EpCAM-/CD45-/DAPI+/8号染色体为三体的CTC;B.EpCAM-/CD45-/DAPI+/8号染色体为四体的CTC;C.EpCAM-/CD45-/DAPI+/8号染色体≥五倍体的CTC;D.EpCAM+/CD45-/DAPI+/8号染色体≥五倍体的CTC;E.EpCAM+的CTM;F.EpCAM-的CTMFigure1 CTC/CTMinperipheralbloodofcervicalcancerpatients(×100)
2.2 宫颈癌患者外周血中CTC/CTM计数基线与临床不良病理特征的关系 不同淋巴结转移情况宫颈癌患者CTC阳性率差异有统计学意义(P<0.05),不同年龄、病理类型和临床分期宫颈癌患者CTC阳性率差异无统计学意义(P>0.05)。不同临床分期和淋巴结转移情况宫颈癌患者CTM阳性率差异有统计学意义(P<0.05),不同年龄、病理类型宫颈癌患者CTM阳性率差异无统计学意义(P>0.05)。见表1。各个分期的初治宫颈癌患者和有淋巴结转移的宫颈癌患者的外周血中均可以检测出CTC,Ⅲ期和Ⅳ期患者 CTC阳性检出率略高于Ⅰ期和Ⅱ期患者。
表1 不同病理特征宫颈癌患者外周血中CTC、CTM阳性率比较
Table 1 Comparison of positive rate of CTC and CTM in peripheral blood of cervical cancer patients with different pathological features (例数,%)
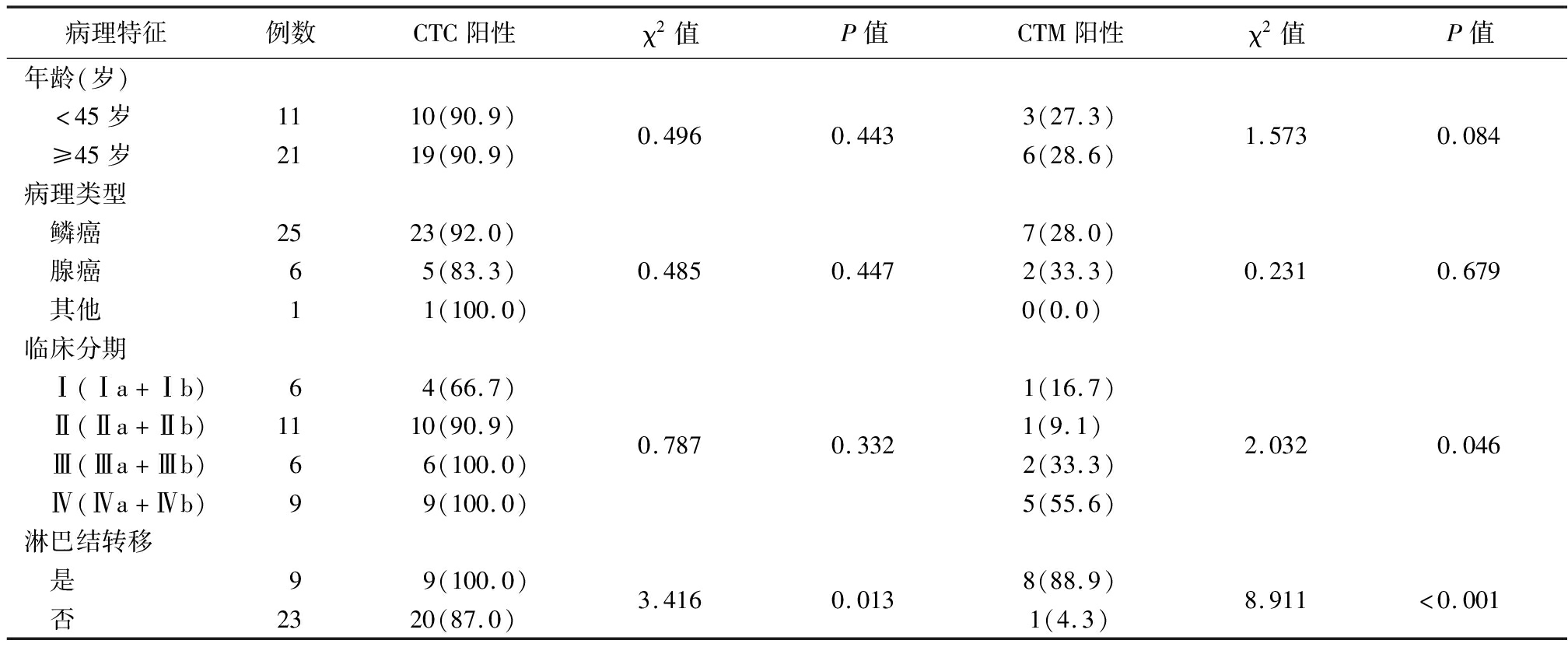
病理特征例数CTC阳性χ2值P值CTM阳性χ2值P值年龄(岁) <45岁 ≥45岁112110(90.9)19(90.9)0.4960.4433(27.3)6(28.6)1.5730.084病理类型 鳞癌2523(92.0)7(28.0) 腺癌65(83.3)0.4850.4472(33.3)0.2310.679 其他1 1(100.0)0(0.0) 临床分期 Ⅰ(Ⅰa+Ⅰb) Ⅱ(Ⅱa+Ⅱb) Ⅲ(Ⅲa+Ⅲb) Ⅳ(Ⅳa+Ⅳb)611694(66.7)10(90.9) 6(100.0) 9(100.0)0.7870.3321(16.7)1(9.1) 2(33.3)5(55.6)2.0320.046淋巴结转移 是 否923 9(100.0)20(87.0)3.4160.0138(88.9)1(4.3)8.911<0.001
2.3 宫颈癌患者外周血中血清标志物CA125、CA199和SCC-Ag的表达水平分布 分析初治32例宫颈癌患者检测时间点1周内的血清肿瘤标志物,检出CA125阳性28例,阳性检出率为87.5%,检出水平范围为25.9~537.7 kU/L,平均(149.9±131.6)kU/L;检出CA199阳性28例,阳性检出率为87.5%,检出水平范围为16.4~190.4 kU/L,平均(70.9±37.1)kU/L;检出SCC-Ag阳性24例,阳性检出率为75.0%,检出水平范围为0.3~10.2 μg/L,平均(4.2±3.0)μg/L。
2.4 宫颈癌患者CTC、CTM与血清标志物的相关性分析 CTC、CTM与CA125、CA199和SCC-Ag均无相关性(P>0.05)。见表2。
表2 宫颈癌患者CTC、CTM与血清标志物的相关性分析
Table 2 Analysis of the correlation between CTC/CTM and serum markers in patients with cervical cancer (n=32,例数)
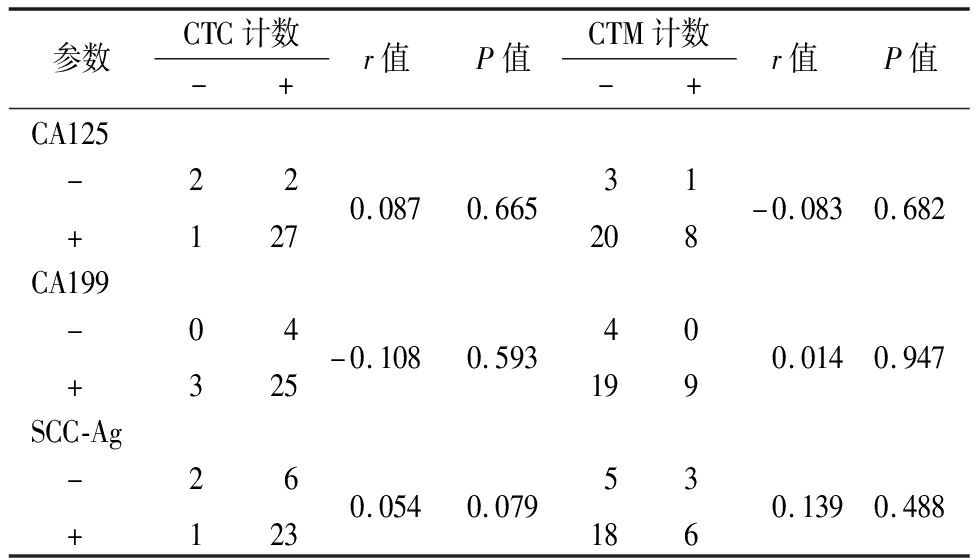
参数CTC计数-+r值P值CTM计数-+r值P值CA125 - +212270.0870.66532018-0.0830.682CA199 - +03425-0.1080.593419090.0140.947SCC-Ag - +216230.0540.079518360.1390.488
3 讨 论
CC发生在子宫颈的上皮,特别是在子宫颈和子宫颈的鳞状小柱交界处,这是一个连续的代谢活动部位[9]。近年来,CC的诊断和治疗取得了重大进展,但总体5年生存率仍然很低[9]。目前,宫颈癌复发转移的诊断主要依赖于医学影像,血清肿瘤标志物,病理组织等手段。CTC/CTM作为一种新兴的肿瘤分子标记物,有助于肿瘤的个体化治疗,为临床早期诊断、疗效和预后评估提供指导。外周血中CTC/CTM检测被认为是实体瘤的“液体活组织检查”,因为其容易形成,发生率高,创伤小[10]。本研究结果表明,CTC阳性检出率为90.63%,在其他研究报道的CTC检测率66.6%~98.1%范围内[11-12];CTM阳性检出率为28.13%。此外,在29例CTC阳性的宫颈癌患者中,三倍体CTC阳性检出率为59.4%;四倍体CTC阳性检出率为55.1%;多倍体CTC阳性检出率为68.8%。本研究结果显示,CC患者外周血CTC阳性率较高,提示术前检测CTC可作为一种新的指标,实时反映CC患者的微转移状态和复发风险,反过来又可以在真正复发之前提供治疗时间。
越来越多的证据证明,CTC/CTM是诊断、预后和药理学目的的临床标志物。因此,CTC/CTM的检测和表征已成为世界范围内的研究热点。CTC/CTM在转移性乳腺癌、结肠癌和前列腺癌中的预后意义已被广泛报道。此外,外周血CTC/CTM作为一种非侵入性指标,将使临床医生能够为宫颈癌患者设计个体化的术后辅助治疗,以减少复发和转移,提高肿瘤患者的生存率和生活质量[13-15]。CTC作为癌症的预后标志物具有良好的应用前景。早期乳腺癌患者每30 mL血液中CTC≥5的预后较差[16]。非转移性结直肠癌患者外周血CTC≥1/7.5 mL时,复发转移风险大,预后差[17]。在各种癌症中,CTC计数与患者年龄、疾病阶段、组织学分化、肿瘤大小和病理类型之间的相关性是不同的。本研究观察了CTC/CTM阳性率与临床病理特征之间的关系。CTC阳性检出率与淋巴结转移呈正相关,与年龄、病理类型和临床分期均无相关。CTM阳性检出率与临床分期和淋巴结转移呈正相关,与年龄、病理类型无相关。此外,各个分期的初治CC患者和有淋巴结转移的CC患者外周血中均可以检测出CTC,Ⅲ期和Ⅳ期患者CTC阳性检出率略高于Ⅰ期和Ⅱ期患者。这些结果表明,外周血中CTC/CTM含量较高的早期CC患者也有较高的风险出现盆腔淋巴结转移[18],与CC的恶性程度密切相关,是不良预后的独立预测因素之一。
肿瘤标志物检测为早期恶性肿瘤的术前预测提供了一种新的解决方案,已从恶性肿瘤患者的血清中检测到一些与肿瘤相关的抗原,且与疾病的临床分期等病理特征有关[19]。与妇科癌症密切相关的恶性肿瘤血清标志物(包括SCC-Ag、AFP、CA153、CEA、CA125和CA199)对评估治疗前、评估疗效和患者预后具有重要价值[20]。SCC-Ag和CA125是目前CC检测的常用标记物[21]。王若琪等[22]研究发现,CA199在CC患者血清中的阳性率升高。本研究收集了CC患者的临床病理数据,并分析了其与术前血清肿瘤标志物的关系,以寻找可预测的危险因素。CA125、CA199、SCC-Ag阳性检出率分别为87.5%、87.5%和75.0%。此外,将CTC/CTM与CA125、CA199和SCC-Ag进行相关分析,未发现CTC/CTM基线计数与3种标记物具有明显相关性。
本研究纳入的目标样本数量偏少,后续研究将扩大样本量作进一步的验证分析,CTC/CTM与肿瘤标志物的临床价值还需要通过大规模多中心研究来深入探究其具体作用机制。
综上所述,同时检测CTC/CTM和和血清肿瘤标志物有助于CC微转移的早期诊断和疾病状态的评估,具有很高的临床应用价值。随着CTC/CTM研究的不断深入,可作为CC精准治疗的临床指标。
[1] Siegel RL,Miller KD,Jemal A.Cancer statistics,2020[J].CA Cancer J Clin,2020,70(1):7-30.
[2] Islami F,Fedewa SA,Jemal A.Trends in cervical cancer incidence rates by age,race/ethnicity,histological subtype,and stage at diagnosis in the United States[J].Prev Med,2019,123:316-323.
[3] Johnson CA,James D,Marzan A,et al.Cervical cancer:an overview of pathophysiology and management[J].Semin Oncol Nurs,2019,35(2):166-174.
[4] Poulet G,Massias J,Taly V.Liquid biopsy:general concepts[J].Acta Cytol,2019,63(6):449-455.
[5] Bu XM,Xu FF,Ma J,et al.The expression of circulating tumor cells in peripheral blood of patients with non-small cell lung cancer and its detection[J].J Biol Regul Homeost Agents,2018,32(4):843-849.
[6] Regmi S,Fu A,Luo KQ.High shear stresses under exercise condition destroy circulating tumor cells in a microfluidic system[J].Sci Rep,2017,7:39975.
[7] 宋艳,刘爱军.第五版WHO女性生殖器官肿瘤分类解读[J].诊断病理学杂志,2021,28(1): 1-4.
[8] 王东存,唐兆瑞,周庆云,等.分析宫颈癌临床病理特征并探讨与宫旁侵犯、盆腔淋巴结转移的关系[J].实用妇科内分泌杂志,2019,6(1):114-115.
[9] Olusola P,Banerjee HN,Philley JV,et al.Human papilloma virus-associated cervical cancer and health disparities[J].Cells,2019,8(6):622.
[10] Diamantopoulou Z,Castro-Giner F,Aceto N.Circulating tumor cells:ready for translation?[J].J Exp Med,2020,217(8):e20200356.
[11] Mascalchi M,Maddau C,Sali L,et al.Circulating tumor cells and microemboli can differentiate malignant and benign pulmonary lesions[J].J Cancer,2017,8(12):2223-2230.
[12] Pfitzner C,Schröder I,Scheungraber C,et al.Digital-direct-RT-PCR:a sensitive and specific method for quantification of CTC in patients with cervical carcinoma[J].Sci Rep,2014,4:3970.
[13] Castro-Giner F,Aceto N.Tracking cancer progression:from circulating tumor cells to metastasis[J].Genome Med,2020,12(1):31.
[14] Alixpanabières C,Pantel K.Clinical applications of circulating tumor cells and circulating tumor DNA as liquid biopsy[J].Cancer Discov,2016,6(5):479-491.
[15] Pan L,Yan G,Chen W,et al.Distribution of circulating tumor cell phenotype in early cervical cancer[J].Cancer Manag Res,2019,11:5531-5536.
[16] Cristofanilli M,Budd GT,Ellis MJ,et al.Circulating tumor cells,disease progression,and survival in metastatic breast cancer[J].N Engl J Med,2004,351(8):781-791.
[17] Bork U,Rahbari NN,Scholch S,et al.Circulating tumour cells and outcome in non-metastatic colorectal cancer:a prospective study[J].Br J Cancer,2015,112(8):1306-1313.
[18] You W,Sheng N,Yan L,et al.The difference in prognosis of stage Ⅱ and Ⅲ colorectal cancer based on preoperative serum tumor markers[J].J Cancer,2019,10(16):3757-3766.
[19] Guo Q,Zhu J,Wu Y,et al.Predictive value of preoperative serum squamous cell carcinoma antigen(SCC-Ag)level on tumor recurrence in cervical squamous cell carcinoma patients treated with radical surgery:a single-institution study[J].Eur J Surg Oncol,2020,46(1):131-138.
[20] Lin W,Cao D,Shen K.Prognostic significance of preoperative serum CEA in primary mucinous ovarian carcinoma:a retrospective cohort study[J].Cancer Manag Res,2018,10:6913-6920.
[21] Huang L,Mo Z,Zhang L,et al.Diagnostic value of albumin to fibrinogen ratio in cervical cancer[J].Int J Biol Markers,2020,35(2):66-73.
[22] 王若琪,韩菲菲.CA125、CA153、CA199和SCC联合检测对宫颈癌的诊断价值[J].实用癌症杂志,2016,31(11):1744-1746.