脑卒中是一种急性脑血管疾病,是一种突然起病的脑血液循环障碍性疾病[1-2]。临床表现为猝然昏扑、不省人事或突然发生口眼歪斜、半身不遂、智力障碍为主要特征。有很多因素或疾病与脑卒中初次发作或复发有密切关系,尽早治疗可以减少致残率和病死率。脑卒中后上肢痉挛是一种速度依赖性的肌张力增高,肌肉过度活动,是上运动神经综合征的常见表现[3]。上肢痉挛影响患者的康复进程,增加治疗难度,对患者的日常生活也造成极大的困扰。临床治疗方法有推拿疗法、生物反馈治疗、中药熏洗疗法、强制运动方法、神经阻滞术等,A型肉毒毒素(botulinum toxin-A,BTX-A)是一种强有力的肌肉松弛剂,在临床缓解肌肉痉挛已超30年,可帮助患者降低局部肌肉张力、改善关节活动度,且无明显不良反应,临床应用范围较广。BTX-A在安全剂量范围内可引起肌肉松弛麻痹,缓解痉挛,常用于脑卒中后不同功能状态的上肢痉挛的治疗[4]。超声具有操作简单、无创,超声引导肌肉注射BTX-A可以准确确定注射点[5]。对于浅表大块肌肉可直接采用徒手定位注射技术,对于深部精细复杂及定位困难的肌肉可用超声进行引导,增加肉毒素的合理分布,从而提高疗效,减少不良反应。本研究将进行治疗的脑卒中后不同功能状态的上肢痉挛患者纳入研究,在超声引导下进行BTX-A注射治疗,观察临床疗效,现报告如下。
1 资料与方法
1.1 一般资料 2019年1月—2020年7月在河北省石家庄市人民医院接受治疗的脑卒中患者中选出60例,均为幕上病变,纳入标准:①符合脑卒中的相关诊断标准[6],并经头颅CT和MRI证实;②肢体为伸肌痉挛模式;③无药物禁忌;④综合痉挛量表(composite spasticity scale,CSS)[7]评分≥10 分;⑤物理康复训练和抗痉挛药物治疗超过2个月无效者,现停用抗痉挛药物超过2 周;⑥初次发病;⑦年龄<75岁,意识清晰,语言沟通无障碍,积极配合治疗;⑧知情且自愿参于研究。排除标准:①伴随自身免疫系统功能障碍;②恶性肿瘤者;③以前注射过BTX-A;④重症肌无力者;⑤之前有过肺部栓塞、急性脑梗死、或脑梗死溶栓治疗史;⑥合并严重器质性疾病或严重糖尿病者;⑦病程超过1年;⑧有过敏反应或哮喘史;⑨重度感染者;⑩伴随类风湿性关节炎或者其他内分泌疾病。按照治疗方法的不同分为对照组(n=30例)和观察组(n=30例)。对照组男性18例、女性12例,年龄55~78岁,平均(66.47±6.39)岁;体重指数19.28~26.85,平均23.03±2.11;脑卒中类型:脑梗死17例、脑出血13例;偏瘫部位:左侧上肢20例,右侧上肢10例。观察组男性17例、女性13例,年龄54~76岁,平均(65.22±6.41)岁;体重指数19.31~27.04,平均23.27±2.49;脑卒中类型:脑梗死16例、脑出血14例;偏瘫部位:左侧上肢21例,右侧上肢9例。两组患者的性别比例、年龄、体重指数、脑卒中类型、偏瘫部位资料差异无统计学意义(P>0.05)。
1.2 治疗方法 对照组接受传统的常规康复疗法,包括运动疗法,物理疗法,中医疗法及利用矫形器进行治疗。观察组除了常规治疗外,再给予超声引导肌肉注射BTX-A(爱力根爱尔兰制药公司,S20030099)注射治疗,超声观察患者上肢肌肉病变情况,找到适合的靶肌肉,在超声引导下用注射针按预定的方案慢慢进针,到达预定位置后停针,将BTX-A注射进去。注射靶肌肉分别为肱二头肌、肱肌、尺侧腕屈肌、桡侧腕屈肌、掌长肌、指浅屈肌、拇长屈肌、肱桡肌、指深屈肌。注射剂量分别为:100 U、60 U、80 U、70 U、40 U、70 U、60 U、50 U、70 U。分多次注射,一个靶肌肉单次注射剂量不超过30 U。注射者由经过系统肉毒毒素注射理论和注射技术培训并通过考核的高年资康复医师负责,严格按照说明书中的安全的剂量范围注射。
1.3 观察指标
1.3.1 肌张力 采用改良Ashworth量表(modified Ashworth scale,MAS)进行分级评定,0级、Ⅰ级、Ⅰ+级、Ⅱ级、Ⅲ级、Ⅳ级分别评分0~4分,评分越高,肌张力增加越严重,活动越困难[8]。
1.3.2 痉挛指数(clinic spasticity index,CSI)[9] 包含腱反射、肌张力、阵挛三个方面。腱反射评分0~4分,0分表示无反射,2分反射正常,4分反射亢进。0分肌张力表示无阻力,2分阻力下降,4分阻力正常,6分阻力轻度或中度加重,8分阻力重度加重。阵挛评分1~4分,分数越高阵挛次数越多、持续时间越长。其中总分0~7分表示无痉挛,8~10分表示轻度痉挛;11~13分表示中度痉挛;14~16分表示重度痉挛。
1.3.3 超声肌肉结构参数(maintenance activity pirmasens,MAP) 采用Supeisonic Imagine Aixplorer型彩色多普勒超声诊断仪(法国超声医学影像公司SUPERSONIC IMAGINE生产)测量患者治疗前、治疗4周后的MAP测量,以肱二头肌为靶目标,测量肌纤维长度(fiber length,FL)、肌纤维厚度(muscular thickness,MT)、剪切模量(modulus of rigidity,G),超声检测均由同一医师团队完成,图像分析由两位经验丰富的医师一起判断,检测结果为两人的共同意见。分析抗痉挛治疗前、治疗后4周MAP的变化趋势和规律。
1.3.4 上肢运动功能和腕指主动关节活动度(initiative joint range of motion,AROM)[10] 采用Fugl-Meyer运动功能评定法(Fugl-Meyer assessment scale,FMA)评估两组患者治疗前、治疗4周后的患者的上肢的运动功能,评分0~2分,共33项目,总分66分[11]。
1.4 统计学方法 应用SPSS 25.0处理数据。计量资料比较采用独立样本t检验和配对t检验,组内多个时间点比较采用重复测量数据的方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 治疗前后的MAS评分比较 两组患者治疗前的MAS评分差异无统计学意义(P>0.05);治疗2周、4周后逐渐下降,观察组的改善程度明显优于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组患者治疗前后的MAS评分比较
Table 1 Comparison of MAS scores between two groups before and after treatment ![]() 分)
分)
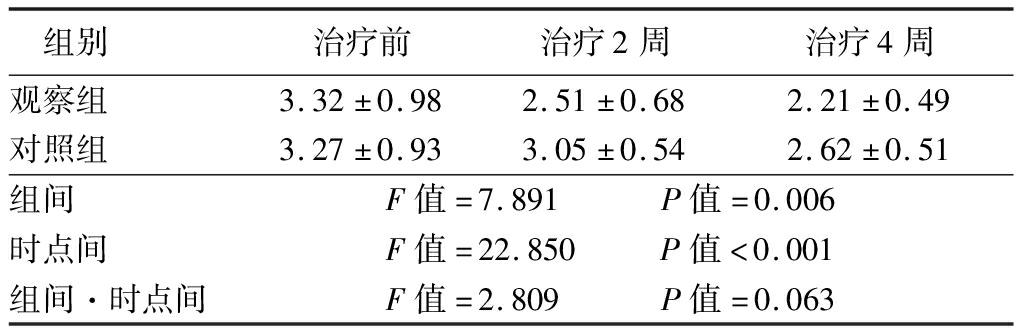
组别 治疗前治疗2周治疗4周观察组 3.32±0.982.51±0.682.21±0.49对照组 3.27±0.933.05±0.542.62±0.51组间 F值=7.891 P值=0.006时点间 F值=22.850 P值<0.001组间·时点间F值=2.809 P值=0.063
2.2 治疗前后的CSI评分比较 治疗4周后观察组患者的CSI评分较对照组低,差异有统计学意义(P<0.05);治疗前、治疗2周后差异无统计学意义(P>0.05)。见表2。
表2 两组患者治疗前后的CSI比较
Table 2 Comparison of CSI scores between two groups before and after treatment ![]() 分)
分)
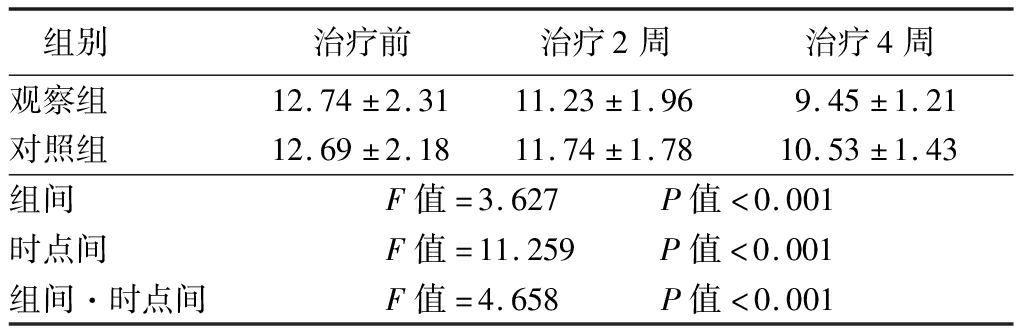
组别 治疗前治疗2周治疗4周观察组 12.74±2.3111.23±1.969.45±1.21对照组 12.69±2.1811.74±1.7810.53±1.43组间 F值=3.627 P值<0.001时点间 F值=11.259 P值<0.001组间·时点间F值=4.658 P值<0.001
2.3 治疗前后的MAP比较 治疗后4周两组G、MT均下降,FL上升,观察组G、MT低于对照组,FL高于对照组,差异有统计学意义(P<0.05);治疗前差异无统计学意义(P>0.05)。见表3。
表3 治疗前后的MAP比较
Table 3 Comparison of MAP between two groups before and after treatment![]()
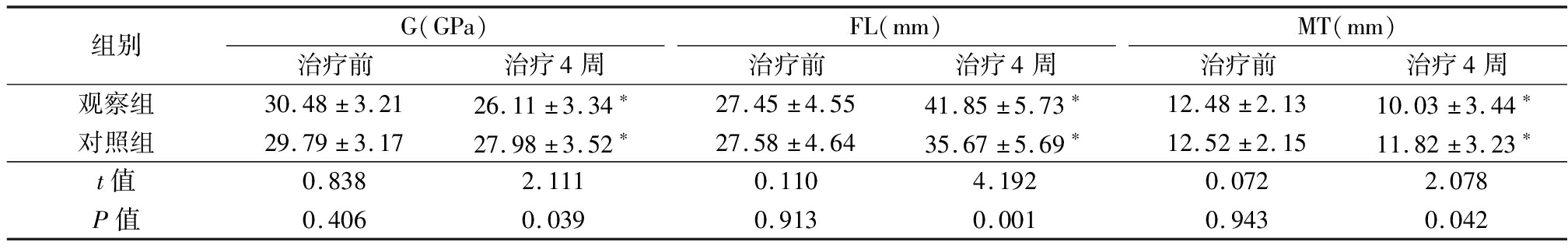
组别G(GPa)治疗前治疗4周FL(mm)治疗前治疗4周MT(mm)治疗前治疗4周观察组30.48±3.2126.11±3.34∗27.45±4.5541.85±5.73∗12.48±2.1310.03±3.44∗对照组29.79±3.1727.98±3.52∗27.58±4.6435.67±5.69∗12.52±2.1511.82±3.23∗t值0.8382.1110.1104.1920.0722.078P值0.4060.0390.9130.0010.9430.042
*P值<0.05与治疗前比较(配对t检验)
2.4 比较FMA-上肢评分和AROM 治疗4周后FMA评分、AROM均有所改善,观察组FMA评分、AROM较对照组高,差异有统计学意义(P<0.05)。见表4。
表4 治疗前后的FMA-上肢评分和AROM比较
Table 4 Comparison of FMA upper limb scores and AROM between two groups before and after treatment![]()
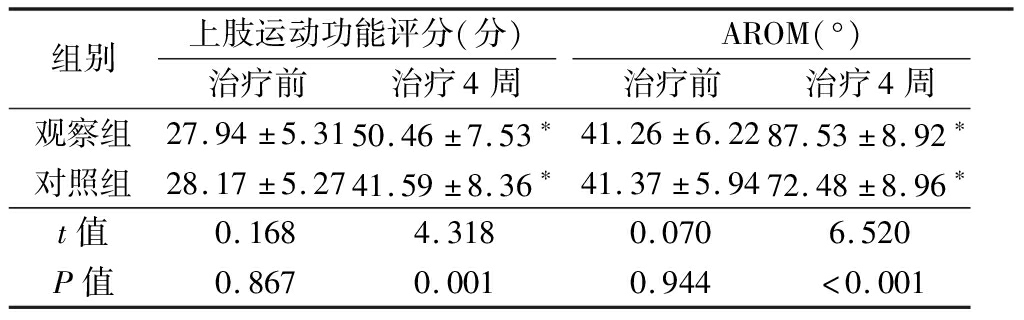
组别上肢运动功能评分(分)治疗前治疗4周AROM(°)治疗前治疗4周观察组27.94±5.3150.46±7.53∗41.26±6.2287.53±8.92∗对照组28.17±5.2741.59±8.36∗41.37±5.9472.48±8.96∗t值0.1684.3180.0706.520P值0.8670.0010.944<0.001
*P值<0.05与治疗前比较(配对t检验)
3 讨 论
上肢痉挛是指上肢肌肉突然、不自主的强直收缩的现象,会造成肌肉僵硬、疼痛难忍。上肢屈肌痉挛跟大脑结构功能是有关系,是脑卒中后常见的并发症之一,这可能与中枢神经有关,炎症反应会导致中枢神经功能异常,无法正常调控肌肉运动[12]。肌肉的伸缩是受大脑指挥,当中风发生后,指挥运动的大脑受到伤害,这部分功能丧失,因此当肌肉向大脑发出信号之后,大脑已经无法再作出反应,这时脊髓处于保护肌肉的原因,会发出信号告诉肌肉收缩。肉毒毒素被应用于临床治疗肌痉挛。超声不仅定位准确,肌骨超声检查技术还可以观察治疗前后的MAP变化规律。
本研究显示,治疗后两组MAS、G、MT下降,FL上升,观察组上述指标的改善情况明显优于对照组。提示超声引导肌肉注射BTX-A注射治疗脑卒中后上肢痉挛可促进患者肌肉功能状态的恢复。分析可能的原因是超声介导精准注射提高靶肌肉被有效募集注射后定量超声能评估和量化肌肉结构的变化,并可依据肌骨超声提供的骨骼肌的变化情况可以对康复干预的治疗效果提供视觉反馈,从而评估肉毒毒素精准治疗的疗效[13]。近年来随着超声技术的发展,利用超声声束扫描人体,通过对反射信号的接收、处理,将声波转换成人体内组织、血管、器官的图像,超声图像信息量丰富、层次清楚,接近解剖真实结构,可以取得各种方位的切面图像,直观、清晰的帮助医生判断病情,制定治疗方案。在超声的引导下医生能精准的将BTX-A作用于靶点,定位准确,提高临床疗效。相关研究[14]在超声引导下肌肉注射肉毒素治疗脑瘫患儿,可有效改善患儿的痉挛问题,促进患儿肌功能的恢复,提高患儿的运动能力。研究发现两组患者治疗前、治疗2周后的CSI评分差异无统计学意义,治疗4周后观察组CSI评分较对照组低。可能是BTX-A是一种强大的神经毒素,作用于神经肌肉接头,可阻断神经肌肉接头的兴奋性介质释放,导致化学去神经作用及局部肌肉麻痹,在受体介导下经细胞内呑作用,神经毒分子选择性地和迅速和神经肌肉接头的胆碱能突触前受体结合,阻断神经-肌接头的兴奋传递,致使肌肉失神经支配,引起肌肉的松弛性麻痹,广泛适用于痉挛管理,超声引导提高准确性,减少其对周围组织的影响[15]。研究结果显示治疗4周后两组FMA评分、AROM均有所改善,观察组患者的FMA评分、关节活动度显著高于对照组。可能是注射BTX-A现在是康复治疗的一部分,可减少康复训练时的阻力,促进主动活动能力的恢复,而肌骨超声介导能大大提高其准确性,并且可评估其疗效,超声作为一项价格低廉,无辐射,适应证广泛的检查项目,具有良好的推广前景[16]。
综上所述,超声可以准确定位,快速找准靶肌,引导BTX-A的注射,显著改善上肢痉挛症状,同时可尽量避免对周围血管及神经系统的损伤,治疗安全性较高,可有助于肌肉功能状态的恢复,关节活动度恢复较好,运动功能恢复更快,应用前景较高。
[1] Hara T,Abo M,Hara H,et al.The Effect of repeated botulinum toxin a therapy combined with intensive rehabilitation on lower limb spasticity in post-stroke patients[J].Toxins(Basel),2018,10(9):2-12.
[2] Herpich F,Rincon F.Management of acute ischemic stroke[J].Crit Care Med,2020,48(11):1654-1663.
[3] Schwarz A,Kanzler CM,Lambercy O,et al.Systematic review on kinematic assessments of upper limb movements after stroke[J].Stroke,2019,50(3):718-727.
[4] Walter U,Dudesek A,Fietzek UM.A simplified ultrasonography-guided approach for neurotoxin injection into the obliquus capitis inferior muscle in spasmodic torticollis[J].J Neural Transm(Vienna),2018,125(7):1037-1042.
[5] Oh HM,Park GY,Choi YM,et al.The effects of botulinum toxin injections on plantar flexor spasticity in different phases after stroke.A secondary analysis from a double-blind,randomized Trial[J].Pm R,2018,10(8):789-797.
[6] 中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2018[J].中华神经科杂志,2018,51(9):666-682.
[7] 郑志宏,邓小蕾,黄亿彩.电刺激定位下注射A型肉毒毒素联合物理治疗脑性瘫痪患儿踝蹠屈肌群痉挛的临床价值分析[J].解放军医药杂志,2020,32(6):46-50.
[8] 郭雪园,王月香,崔建博,等.剪切波超声弹性成像与痉挛临床评估的相关性分析[J].中华保健医学杂志,2020,22(5):481-483.
[9] 樊留博,刘宝华,韩文胜.超声弹性成像评价股四头肌神经入肌点针刺法治疗脑梗死肌痉挛的临床疗效[J].临床超声医学杂志,2019,21(4):263-266.
[10] Ahn SY,Ko H,Yoon JO,et al.Determining the reliability of a new method for measuring joint range of motion through a randomized controlled trial[J].Ann Rehabil Med,2019,43(6):707-719.
[11] 陈少发,马强,赵君豪,等.基于上肢运动评分的动作检测与动作识别的方法研究[J].中国康复医学杂志,2019,34(6):707-710.
[12] 刘夕霞,陈启波,梁辉,等.超声引导下脑卒中后偏瘫肩痛的临床特征及疗效研究[J].广西医科大学学报,2019,36(10):1606-1610.
[13] Terlemez R,Ercalik T.Effect of piriformis injection on neuropathic pain[J].Agri,2019,31(4):178-182.
[14] Multani I,Manji J,Hastings-Ison T,et al.Botulinum toxin in the management of children with cerebral palsy[J].Paediatr Drugs,2019,21(4):261-281.
[15] 马善新,许建文,龙耀斌,等.超声引导下A型肉毒毒素治疗卒中后不同时期的跖屈肌痉挛[J].中国组织工程研究,2019,23(27):4300-4304.
[16] Liao J,Yang H,Yu J,et al.Progress in the application of ultrasound elastography for brain diseases[J].J Ultrasound Med,2020,39(11):2093-2104.