宫颈癌在女性恶性肿瘤中较为常见,是主要的致死病种,严重威胁着我国女性健康。宫颈癌的主要治疗手段包括手术、放疗以及化疗等药物治疗,目前对于术后有高危因素的患者的标准治疗方案为术后放疗联合铂类为基础的同步化疗[1-2]。然而由于放化疗骨髓抑制的叠加作用,致3、4级血液学毒性发生率较高[3],使得放化疗难以顺利实施,严重影响患者的治疗效果,甚至危及患者生命。骨盆骨是成人造血主要场所之一,而妇瘤放疗常规需要全盆腔区域淋巴结照射既往研究表明,盆腔放疗导致的血液学毒性与照射野内骨髓受照的剂量及体积相关[4],因此在放疗过程中实施保护骨髓的照射,有望减轻骨髓抑制,保证同步放化疗的顺利进行,进而保证疗效。调强放疗(intensity modulated radiation therapy,IMRT)相比于传统三维适形放疗(three dimensional conformal radiation therapy,3D-CRT)可明显降低正常组织受照剂量[5],现已广泛应用于临床治疗中,目前宫颈癌术后放疗计划中,骨髓未作为常规危及器官进行保护,因此本研究设计保护骨髓调强放疗(bone marrow sparing-intensity modulated radiation therapy,BMS-IMRT)计划,与普通调强放疗计划对比,进行剂量学分析,探讨BMS-IMRT在临床应用中的可行性。
1 资料与方法
1.1 一般资料 选取2019年5月—2019年11月期间于我科诊治的宫颈癌根治术后患者10例,年龄29~69岁,平均(49.60±12.71)岁,术后病理明确为恶性肿瘤,其中鳞癌8例,腺癌2例,所有患者均接受了广泛子宫及双附件切除+盆腔淋巴结清扫术,术后病理未发现腹主动脉旁及盆腔淋巴结转移,所有患者均存在术后高危因素,符合NCCN指南推荐的Sedlis标准具有术后放化疗指征。
1.2 CT模拟定位 采用Philips大孔径CT进行模拟定位,患者定位前2 h排空膀胱及直肠,后口服500 mL水并憋尿,定位时取仰卧位,体部热塑膜固定,静脉注射碘海醇100 mL后行强化扫描,扫描范围上界为肾门水平,下界至坐骨结节下2 cm,扫描层厚为3 mm,定位图像传送至Monaco治疗计划系统。
1.3 靶区勾画及剂量 采用Monaco5.11.01系统,将定位CT与相同体位盆腔MR进行融合,依据RTOG推荐的宫颈癌术后靶区勾画指南[6]及Taylor的盆腔淋巴结勾画指南[7]勾画临床靶区(clinical target volume,CTV),包括阴道上1/2、阴道残端、阴道旁组织和盆腔淋巴引流区(髂总、髂内、髂外、闭孔及骶前淋巴引流区)。计划靶区(planning target volume,PTV)为CTV在外扩5 mm形成。危及器官(organs at risk,OARs)包括以下组织:直肠、膀胱、左右股骨头及盆腔骨髓。盆腔骨髓的勾画范围为PTV上下1 cm范围,包括部分腰椎、骶骨、髂骨、坐骨、耻骨、双侧股骨头以及部分股骨。治疗剂量为95%PTV给予50 Gy/25 f,2 Gy/f。OARs剂量体积限制为:直肠V40≤50%,膀胱V40≤50%,股骨头V50≤5%,骨髓V10≤90%,V20≤76%。
1.4 计划设计制作与实施 对于研究内患者分别制作常规IMRT及BMS-IMRT两种治疗计划。计划制作采用Monaco5.11治疗计划系统,能量选用的6MV X射线,采用MC(Monte Carlo)算法,计算网格为3 mm,最小子野宽度设为0.5 cm,总射野蒙卡不确定度为1。首先,制定9野均分的铅门固定的IMRT计划,剂量率为600 MU/min,计划优化时选择“Park Leaf Gap Under Jaw”功能,记为IMRT-1。修改机器配置文件,去除“Park Leaf Gap Under Jaw”功能,不改变优化条件、射野方式及其他优化参数,重新优化得到的IMRT计划,记为IMRT-2。最后,将两组计划进行剂量归一,使PTV的V50均为95%。IMRT计划设置优先顺序为PTV>直肠>膀胱>股骨头,BMS-IMRT计划设计优先顺序则为PTV>骨髓>直肠>膀胱>股骨头,余设置相同。
1.5 评价指标 ①PTV分析指标:Dmax为PTV所接受的最大剂量;Dmin为PTV所接受的最低剂量;Dmean为PTV所接受的平均剂量;均匀性指数(homogeneity index,HI)为D5%/D95%。HI值越低(即越接近 1),表示靶区剂量均匀性越好;适形度指数![]() 其中VRX为处方剂量所涵盖的靶区体积,TV为靶区的体积,VRI为处方剂量涵盖的总体积。CI值为0~l,越接近1表示适形度越好。②OARs分析指标:直肠V30、V40、V45(直肠接受30、40、45 Gy照射的体积占比);膀胱V30、V40、V45(膀胱接受30、40、45 Gy照射的体积占比);股骨头Dmax(接受的最大剂量);骨髓V10、V20、V30、V40(骨髓接受10、20、30、40 Gy剂量照射的体积百分比)。
其中VRX为处方剂量所涵盖的靶区体积,TV为靶区的体积,VRI为处方剂量涵盖的总体积。CI值为0~l,越接近1表示适形度越好。②OARs分析指标:直肠V30、V40、V45(直肠接受30、40、45 Gy照射的体积占比);膀胱V30、V40、V45(膀胱接受30、40、45 Gy照射的体积占比);股骨头Dmax(接受的最大剂量);骨髓V10、V20、V30、V40(骨髓接受10、20、30、40 Gy剂量照射的体积百分比)。
1.6 统计学方法 应用SPSS 26.0统计软件进行数据分析。计量资料比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 PTV的剂量学比较 两种计划的D95%均归一到50Gy,CI比较差异无统计学意义(P>0.05),故两种计划的靶区覆盖均能达临床要求,但BMS-IMRT计划PTV的平均Dmax与Dmean均高于IMRT计划,且HI劣于IMRT计划,差异有统计学意义(P<0.05),见表1。患者两种计划的等剂量曲线见图1。患者两种计划的PTV的DVH见图2。
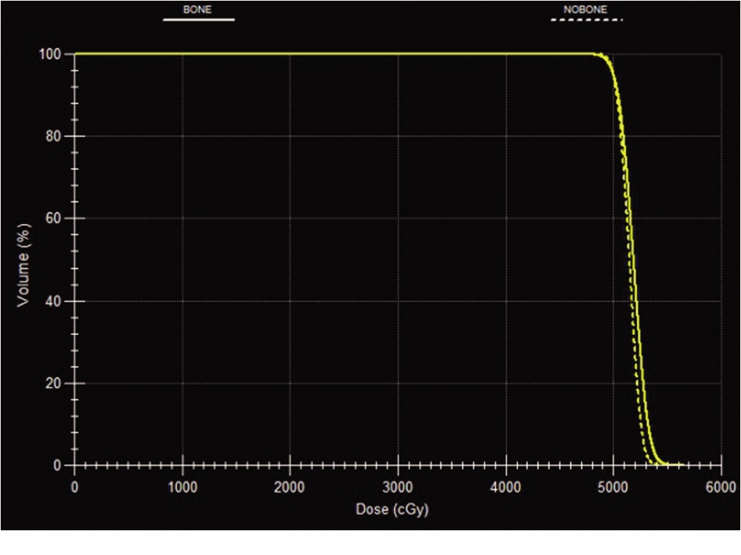
图2 示例患者两种计划的PTV的DVH图
Figure 2 Dose-volume histograms of PTV in the two plans for the sample patient
表1 IMRT与BMS-IMRT计划PTV的剂量学参数比较
Table 1 Dosimetric comparison of PTV between IMRT and BMS-IMRT ![]()
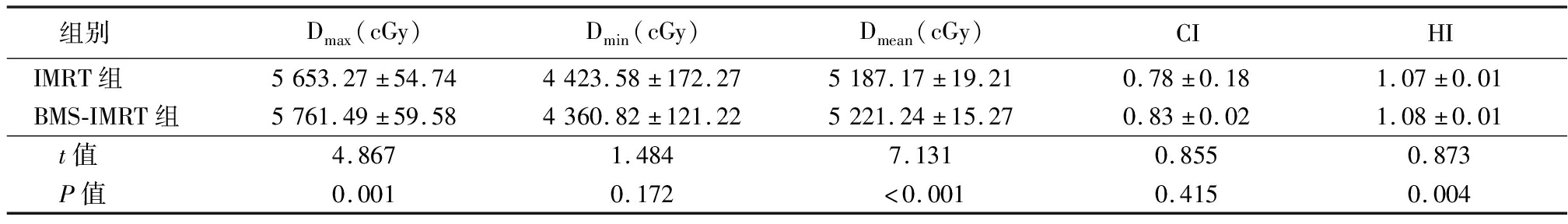
组别Dmax(cGy)Dmin(cGy)Dmean(cGy)CIHIIMRT组5653.27±54.744423.58±172.275187.17±19.210.78±0.181.07±0.01BMS-IMRT组5761.49±59.584360.82±121.225221.24±15.270.83±0.021.08±0.01t值4.8671.4847.1310.8550.873P值0.0010.172<0.0010.4150.004
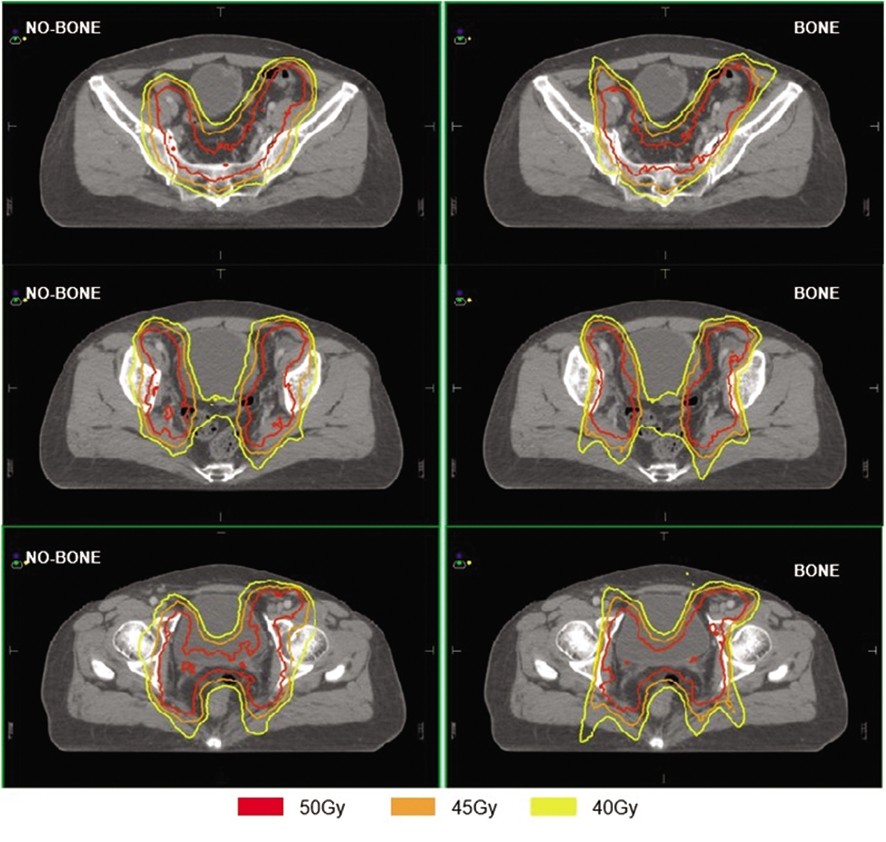
图1 示例患者两种计划不同层面的等剂量曲线分布图
Figure 1 Isodose distribution curve at different levels of the two plans for the sample patient
2.2 OARs分析指标 BMS-IMRT计划中平均的骨髓V10、V20、V30、V40均低于IMRT计划,股骨头Dmax低于IMRT计划,差异有统计学意义(P<0.05),两种计划中直肠、膀胱的受照剂量比较差异均无统计学意义(P>0.05),见表2。患者两种计划骨髓的DVH见图3,患者直肠及膀胱的DVH见图4。
表2 IMRT与BMS-IMRT计划OARs的剂量学比较
Table 2 Dosimetric comparison of OARs between IMRT and BMS-IMRT![]()
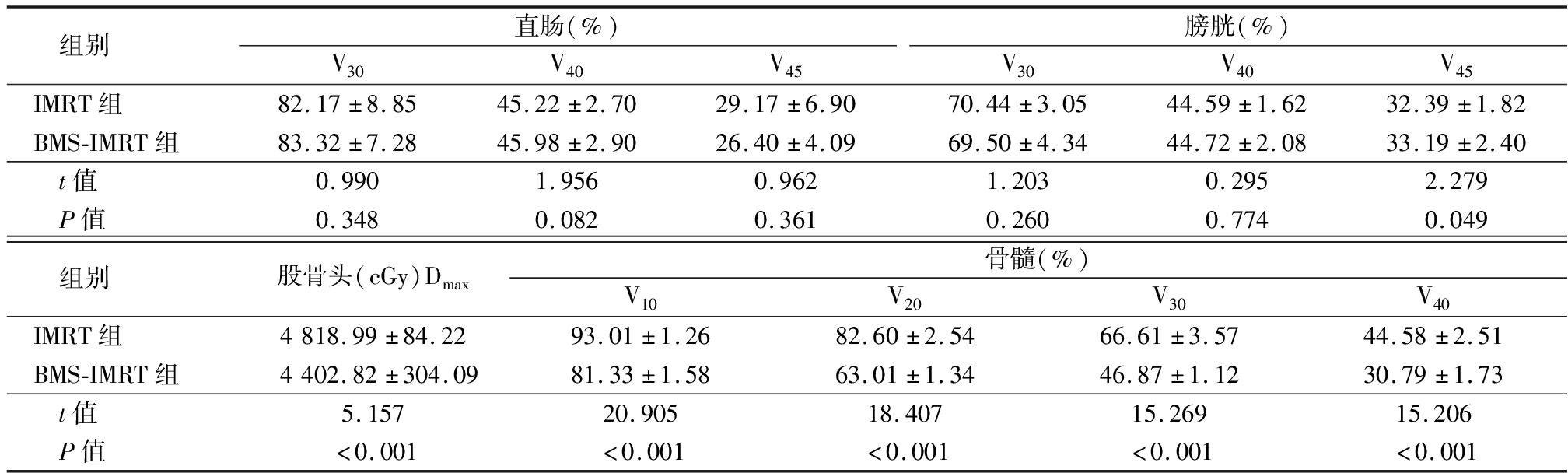
组别直肠(%)V30V40V45膀胱(%)V30V40V45IMRT组82.17±8.8545.22±2.7029.17±6.9070.44±3.0544.59±1.6232.39±1.82BMS-IMRT组83.32±7.2845.98±2.9026.40±4.0969.50±4.3444.72±2.0833.19±2.40t值0.9901.9560.9621.2030.2952.279P值0.3480.0820.3610.2600.7740.049组别股骨头(cGy)Dmax骨髓(%)V10V20V30V40IMRT组4818.99±84.2293.01±1.2682.60±2.5466.61±3.5744.58±2.51BMS-IMRT组4402.82±304.0981.33±1.5863.01±1.3446.87±1.1230.79±1.73t值5.15720.90518.40715.26915.206P值<0.001<0.001<0.001<0.001<0.001
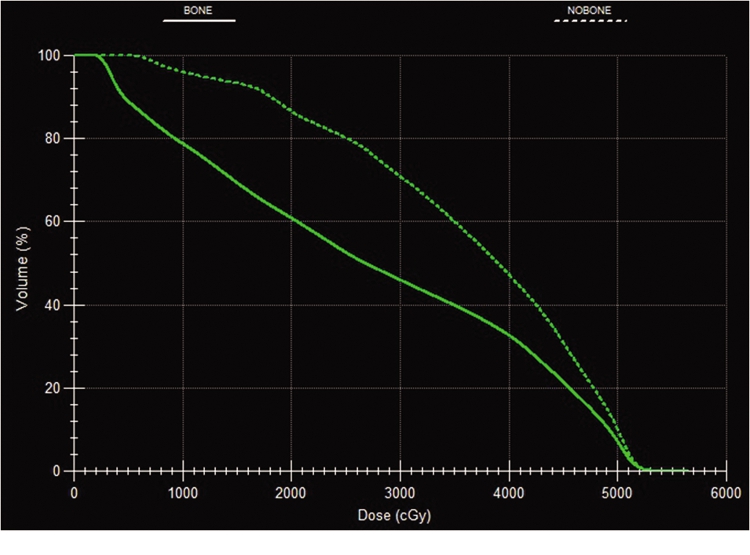
图3 示例患者两种计划的骨髓的DVH图
Figure 3 Dose-volume histograms of bone marrow in the two plans for the sample patient
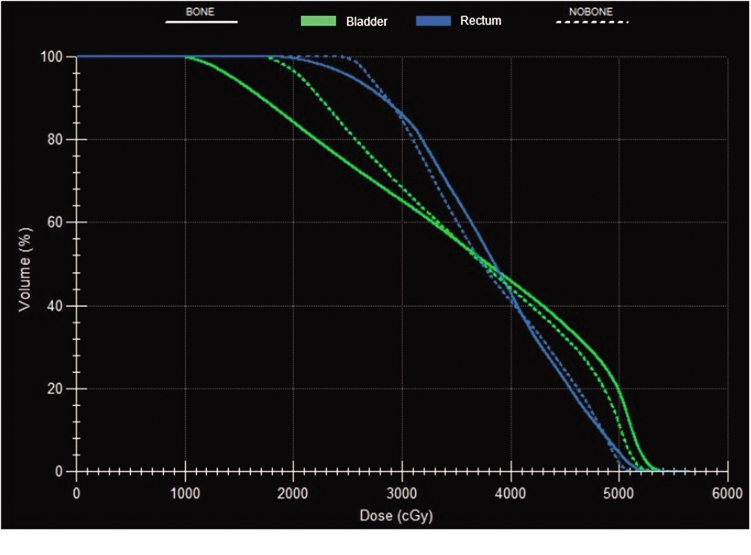
图4 示例患者直肠及膀胱的DVH图
Figure 4 Dose-volume histograms of the rectum and bladder in the two plans for the sample patient
3 讨 论
放疗联合含铂类药物同步化疗是宫颈癌术后具有高危因素患者的标准治疗方案[1-2],能提高肿瘤局部控制率,改善患者预后。但由于放疗和化疗均具有骨髓抑制的不良反应,两者叠加使得血液学毒性成为阻碍治疗顺利进行的主要因素,影响患者的治疗效果,严重时甚至可危及生命,因此如何改善宫颈癌同步放化疗中血液学毒性的发生是临床工作中的关键问题。骨盆骨是成人造血的重要场所,有超过人体1/2的活性骨髓位于照射野内的盆腔骨髓中。骨髓中含有丰富的造血干细胞及幼稚细胞,增殖较快对射线高度敏感,因此盆腔放疗可损伤骨髓造血干细胞,导致骨髓抑制的发生。而宫颈癌术后盆腔放疗的靶区较大,几乎覆盖全部骨盆骨组织。故改进放疗技术,减少盆腔骨髓受照剂量是解决这一临床问题的有效措施。IMRT因为其良好的靶区及剂量适形度,已广泛应用于临床。Hui等[8]对比分析了宫颈癌同步放化疗患者IMRT及3D-CRT技术,发现IMRT可有效减少盆腔骨髓30 Gy以上受照体积,并降低急性血液学毒性的发生。Naik等[9]将宫颈癌患者随机分为IMRT计划和3D-CRT组,结果同样显示IMRT技术可以明显降低盆腔骨髓的V20,使得血液学毒性的发生程度减低。在此基础上我们推测在IMRT技术中进一步优化骨髓受量能够更好保护骨髓造血细胞,降低骨髓抑制的发生,因此本研究即对比分析BMS-IMRT与普通IMRT的剂量学差异,为其实际临床应用提供理论基础。
骨髓从放射生物角度属于“并联器官”,因此其血液学毒性与照射体积应具有一定关系。RTOG 0418试验收录了宫颈癌术后同步放化疗患者,结果显示骨髓V40>37%时发生2级及以上血液学毒性的概率明显增加[10-11]。Rose等[12]对于宫颈癌术后同步放化疗患者建立了正常组织不良反应发生概率模型,研究发现骨髓V10≥95%,V20≥76%更易发生3级及以上白细胞减少症。Albuquerque等[13]研究了宫颈癌同步放化疗患者与血液学毒性发生相关的潜在预测因素,结果显示骨髓受量V20是2级及以上血液学毒性(HT2+)的独立预测因子,如果盆腔骨髓V20>80%,HT2+的发生风险将增加4.5倍。因此,盆腔放疗血液学毒性与骨髓受照体积明显相关,尤其是V10、V20等低剂量照射指标。本研究中BMS-IMRT计划采用的骨髓限值为V10≤90%,V20≤76%,即参考了以上研究结果。
BMS-IMRT在普通调强放疗的基础上对骨髓进行剂量限制,理论上可进一步降低骨髓受照剂量。本研究的结果显示BMS-IMRT计划骨髓的V10、V20、V30、V40较常规IMRT计划降低(P<0.05),与最初的设想一致。Murakami等[14]对比了宫颈癌术后调强放疗是否限制骨髓的两种计划,结果显示盆腔骨髓所受的高低剂量体积均能通过BMS-IMRT计划进一步降低。肖锋等[15]研究也得出了类似的结果,进一步证实了这一理论设想。此外,本研究还得出,BMS-IMRT计划靶区的覆盖率及适形度与IMRT计划差异无统计学意义,直肠、膀胱的受量的差异亦无意义,同时BMS-IMRT计划还可以降低股骨头的最大受照射剂量。这与近期Bao等[16]的研究结果相符。但本研究中BMS-IMRT计划中靶区的剂量均匀性较差,这可能与限制骨髓受量后射野内子野的分布变化有关,但并未影响治疗靶区的覆盖及适形度,说明BMS-IMRT计划在保证更低的骨髓受照剂量的同时,并没有影响治疗靶区的剂量分布,而且不增加其它危及器官的受照剂量,因此推测,将BMS-IMRT技术应用于临床,有望在保证靶区受照剂量的前提下更好地保护骨盆骨的造血功能,提高患者的耐受性。另外Jodda等[17]纳入了50例宫颈癌患者采用4野3D-CRT、7野IMRT及拉弧的VMAT技术进行分析,结果显示3种技术治疗靶区的覆盖情况基本相似,但3D-CRT组危及器官的保护最差,IMRT与VMAT技术对于骨髓的剂量限制相当,但VMAT技术不良反应的发生率更低,这也提示可以尝试应用VMAT、TOMO等新技术来进一步减少盆腔骨髓的照射。
综上所述,BMS-IMRT相较于普通IMRT计划能够进一步降低骨髓的受照剂量,理论上可能减轻血液学毒性,同时保证治疗靶区的覆盖且不增加其它危及器官的受量,有较好的临床意义,但本研究仅为剂量学研究,今后可进一步设计大规模前瞻性随机对照研究以证实其临床优势。
[1] Lee KB,Shim SH,Lee JM.Comparison between adjuvant chemotherapy and adjuvant radiotherapy/chemoradiotherapy after radical surgery in patients with cervical cancer:a meta-analysis[J].J Gynecol Oncol,2018,29(4):e62.
[2] Mell LK,Sir k I,Wei L,et al.Bone marrow-sparing intensity modulated radiation therapy with concurrent cisplatin for stage IB-IVA cervical cancer:an international multicenter phase II clinical trial(INTERTECC-2)[J].Int J Radiat Oncol Biol Phys,2017,97(3):536.
k I,Wei L,et al.Bone marrow-sparing intensity modulated radiation therapy with concurrent cisplatin for stage IB-IVA cervical cancer:an international multicenter phase II clinical trial(INTERTECC-2)[J].Int J Radiat Oncol Biol Phys,2017,97(3):536.
[3] Marjanovic D,Karapandzic VP,Rundic SS,et al.Acute toxicity of postoperative intensity-modulated radiotherapy and three-dimensional conformal radiotherapy for cervical cancer:The role of concomitant chemotherapy[J].J BUON,2019,24(6):2347-2354.
[4] Nicholas S,Chen L,Choflet A,et al.Pelvic radiation and normal tissue toxicity[J].Semin Radiat Oncol,2017,27(4):358.
[5] Marjanovic D,Karapandzic VP,Rundic SS,et al.Implementation of intensity-modulated radiotherapy and comparison with three-dimensional conformal radiotherapy in the postoperative treatment of cervical cancer[J].J BUON,2019,24(5):2028-2034.
[6] Small JW,Mell LK,Anderson P,et al.Consensus guidelines for delineation of clinical target volume for intensity-modulated pelvic radiotherapy in postoperative treatment of endometrial and cervical cancer[J].Int J Radiat Oncol Biol Phys,2008,71(2):428-434.
[7] Taylor A,Rockall AG,Reznek RH,et al.Mapping pelvic lymph nodes:guidelines for delineation in intensity-modulated radiotherapy[J].Int J Radiat Oncol Biol Phys,2005,63(5):1604-1612.
[8] Hui B,Zhang Y,Shi F,et al.Association between bone marrow dosimetric parameters and acute hematologic toxicity in cervical cancer patients undergoing concurrent chemoradiotherapy:comparison of three-dimensional conformal radiotherapy and intensity-modulated radiation therapy[J].Int J Gynecol Cancer,2014,24(9):1648-1652.
[9] Naik A,Gurjar OP,Gupta KL,et al.Comparison of dosimetric parameters and acute toxicity of intensity-modulated and three-dimensional radiotherapy in patients with cervix carcinoma:a randomized prospective study[J].Cancer Radiother,2016,20(5):370-376.
[10] Jhingran A,Winter K,Portelance L,et al.A phase II study of intensity modulated radiation therapy to the pelvis for postoperative patients with endometrial carcinoma:radiation therapy oncology group trial 0418[J].Int J Radiat Oncol Biol Phys,2012,84(1):e23-e28.
[11] Klopp AH,Moughan J,Portelance L,et al.Hematologic Toxicity in RTOG 0418:A Phase 2 Study of postoperative IMRT for gynecologic cancer[J].Int J Radiat Oncol Biol Phys,2013,86(1):83-90.
[12] Rose BS,Aydogan B,Liang Y,et al.Normal tissue complication probability modeling of acute hematologic toxicity in cervical cancer patients treated with chemoradiotherapy[J].Int J Radiat Oncol Biol Phys,2011,79(3):800-807.
[13] Albuquerque K,Giangreco D,Morrison C,et al.Radiation-related predictors of hematologic toxicity after concurrent chemoradi ation for cervical cancer and implications for bone marrow-sparing pelvic IMRT[J].Int J Radiat Oncol Biol Phys,2011,79(4):1043-1047.
[14] Murakami N,Okamoto H,Kasamatsu T,et al.A dosimetric analysis of intensity-modulated radiation therapy with bone marrow sparing for cervical cancer[J].Anticancer Res,2014,34(9):5091-5098.
[15] 肖锋,李云海,王洪林,等.宫颈癌术后保护骨髓的调强放疗剂量学研究[J].中国癌症杂志,2013,23(3):200-206.
[16] Bao Z,Wang D,Chen S,et al.Optimal dose limitation strategy for bone marrow sparing in intensity-modulated radiotherapy of cervical cancer[J].Radiation Oncol,2019,14(1):118.
[17] Jodda A,Urbanski B,Piotrowski T,et al.Relations between doses cumulated in bone marrow and dose delivery techniques during radiation therapy of cervical and endometrial cancer[J].Phys Med,2017,36:54-59.