胃癌是我国发病率和病死率较高的消化系统肿瘤。术前新辅助化疗由于具有降低肿瘤分期、提高R0切除(根治性手术切除)率等优势,被推荐为进展期胃癌的标准治疗[1-3]。据文献报道,胃癌患者营养不良发生率为87%,恶病质的发生率高达65%~85%[4]。化疗可以直接影响新陈代谢,或因引起恶心、呕吐、腹泻、味觉改变、胃肠道黏膜损伤以及厌食而间接影响营养物质的摄入,进一步加重机体营养不良[5-7]。营养不良不仅影响放化疗的敏感度和耐受度,还与随后的手术治疗结局密切相关。在我国,随着多学科协作(multi-disciplinary team,MDT)的成立以及全程营养管理的开展,MDT如何发挥多学科优势,参与到患者的营养管理中,以改善胃癌患者的营养状况已成为亟待解决的问题。本研究针对胃癌新辅助化疗患者积极开展MDT的全程营养管理,探讨其在改善新辅助化疗患者营养状况、提高化疗顺应性和治疗效果中的作用,为胃癌患者的营养管理提供参考依据。
1 资料与方法
1.1 一般资料 选取2018年3月—2019年3月入住江苏省肿瘤医院普外科接受新辅助化疗的胃癌患者60例。按随机数字表法随机分为研究组和对照组,每组30例。纳入标准:①经病理和影像学等临床资料明确诊断为胃癌,且为初诊初治;②拟行新辅助化疗;③年龄≥18岁,意识清楚,愿意参加研究。排除标准:①有其他严重消化系统疾病、营养代谢疾病病史;②有其他恶性肿瘤病史;③合并严重心肺、肝肾功能障碍;④对肠内、肠外营养成分过敏或不能耐受;⑤患者中途要求退出;⑥同时接受其他临床试验。
本研究通过医院伦理委员会审查,患者知情同意并签署知情同意书。
1.2 研究方法 两组患者接受的其他治疗措施均相同。两组均采用替吉奥胶囊联合注射用奥沙利铂新辅助化疗方案,即第1天静脉滴注奥沙利铂130 mg/m2,第1~14天口服替吉奥80 mg/m2,2次/d,21 d重复1次,共连续治疗2个周期。
新辅助化疗期间,对照组实施常规营养管理,包括入院时、每次化疗前后的营养评估、健康宣教。研究组在常规营养管理的基础上,实施以MDT全程营养管理,主要参考《肿瘤患者营养支持指南》、《成人口服营养补充专家共识》、《化疗患者营养治疗指南》及《胃癌患者营养治疗指南》[8-11]。营养药师从患者入院时即开始实施营养干预,指导患者记录饮食情况,并通过营养查房等形式详细了解患者进食情况,包括进食量、饮食习惯、口味偏好、排便情况、是否有恶心、呕吐、腹胀、腹痛、便秘、腹泻等症状,定期组织MDT讨论分析,制定营养方案。
MDT营养管理小组由临床医师、营养专科临床药师、营养专科护士、肿瘤专科护士组成,各成员接受了统一的培训,按照统一标准对患者进行营养管理。主要工作内容如下:①临床药师负责建立患者营养管理档案,采用营养风险筛查评估表(nutrition risk screening,NRS2002)进行营养风险筛查,如NRS2002<3分,每周重复筛查1次;如NRS2002≥3分,则存在营养风险,需要进一步采用患者自评主观整体营养评估量表(Scored Patient-Generated Subjective Global Assessment,PG-SGA)对患者进行营养评估,如PG-SGA≤3分,无需营养干预;如4分≤PG-SGA≤8分,给予营养支持并按期手术;如PG-SGA≥9分,需给予7~10 d营养支持再行手术治疗。监测营养相关指标评估营养状况及营养支持效果,依据营养的五阶梯治疗调整营养方案,为患者选择适宜的营养制剂,如糖尿病患者选用糖尿病专用配方制剂,便秘的患者选用富含膳食纤维的制剂,肝功能差的患者选用富含中链脂肪酸的制剂;如需给予肠外营养,针对患者的肝肾功能、凝血功能、电解质水平等组方。监测营养相关并发症和化疗不良反应等,比如患者出现明显腹胀,评定患者是否对营养制剂不耐受,可更换另一种制剂,或者考虑患者胃肠道动力障碍或消化液分泌不足等原因,可给予促胃动力药或消化酶制剂。②临床医师根据临床药师的营养风险筛查和评估结果,结合血常规、生化、机体成分分析、握力等进行营养状况综合评定,并实施新辅助化疗和营养治疗;③营养专科护士负责个性化指导患者饮食,如指导患者宜进食易消化的食物,少食多餐,细嚼慢咽,避免进食粗纤维、不易消化或易胀气的食物,如韭菜、萝卜、碳酸饮料等;出院后随访并记录;④肿瘤专科护士负责宣教化疗相关不良反应,缓解患者紧张、焦虑的情绪。
1.3 评价指标 记录患者入组编号、姓名、住院号、性别、年龄、基础疾病、身高、体重、新辅助化疗时间、新辅助化疗方案等,主要研究指标为体重变化,记录治疗前、治疗1个周期后和治疗2个周期后的体重变化;次要研究指标为营养指标变化和化疗相关不良反应的发生率,监测治疗前和治疗2个周期后的营养指标变化(包括血清总蛋白、血清白蛋白、血清前白蛋白);记录治疗期间化疗相关不良反应的发生情况[(包括恶心或呕吐、腹泻、血胆红素降低、丙氨酸转氨酶(alanine aminotransferase,ALT)或天冬氨酸转氨酶(aspartate transaminase,AST)降低、白细胞计数(white blood cell,WBC)降低、血红蛋白(hemoglobin,Hb)减少、血小板计数降低、外周神经毒性)]。
1.4 统计学方法 应用SPSS 19.0统计学软件进行数据处理。计数资料比较采用χ2检验或者Fisher精确检验。若计量资料符合正态分布者比较采用独立样本t检验或近似t检验;非正态分布者采用Mann-Whitney U检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 研究组和对照组的性别、年龄、肿瘤浸润深度、淋巴结转移差异均无统计学意义(P>0.05)。在新辅助化疗前,两组的体重、血清总蛋白、血清白蛋白、血清前白蛋白差异均无统计学意义(P>0.05)。见表1。
表1 两组患者一般资料比较 (n=30)
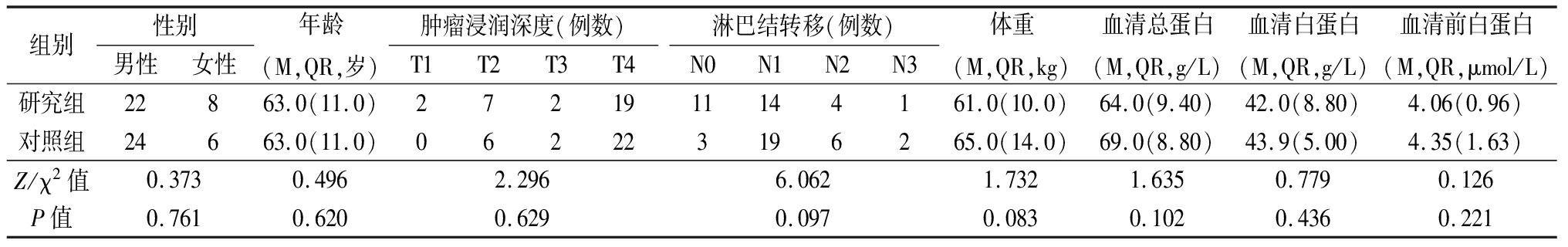
组别性别男性女性年龄(M,QR,岁)肿瘤浸润深度(例数)T1T2T3T4淋巴结转移(例数)N0N1N2N3体重(M,QR,kg)血清总蛋白(M,QR,g/L)血清白蛋白(M,QR,g/L)血清前白蛋白(M,QR,μmol/L)研究组22863.0(11.0)2721911144161.0(10.0)64.0(9.40)42.0(8.80)4.06(0.96)对照组24663.0(11.0)062223196265.0(14.0)69.0(8.80)43.9(5.00)4.35(1.63)Z/χ2值0.3730.4962.2966.0621.7321.6350.7790.126P值0.7610.6200.6290.0970.0830.1020.4360.221
2.2 体重变化 治疗1个周期后,两组患者的体重变化差异无统计学意义(P>0.05);治疗2个周期后,对照组的体重较治疗前减少,而研究组的体重较治疗前趋于稳定或有所增加,两组的体重变化差异有统计学意义(P<0.05)。研究组治疗2周期后与治疗1周期后的体重变化差异无统计学意义(P>0.05),而对照组治疗2周期后与治疗1周期后的体重变化差异有统计学意义(P<0.05),见表2。
表2 两组治疗前、后体重变化比较 (n=30,M,QR,kg)
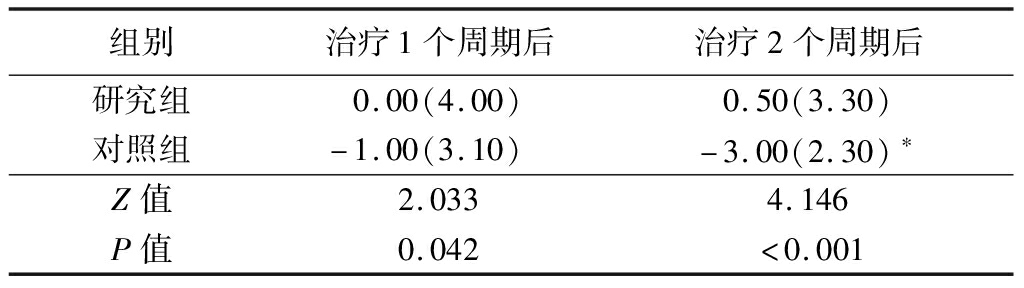
组别治疗1个周期后治疗2个周期后研究组0.00(4.00)0.50(3.30)对照组-1.00(3.10)-3.00(2.30)∗Z值2.0334.146P值0.042<0.001
*P值<0.05与治疗1个周期后的体重变化比较(Mann-Whitney U检验)
2.3 营养指标变化 治疗2个周期后,两组的血清总蛋白、血清白蛋白变化差异有统计学意义(P<0.05),而两组血清前白蛋白变化差异无统计学意义(P>0.05),见表3。
表3 两组治疗前、后营养指标变化比较 (n=30,M,QR)
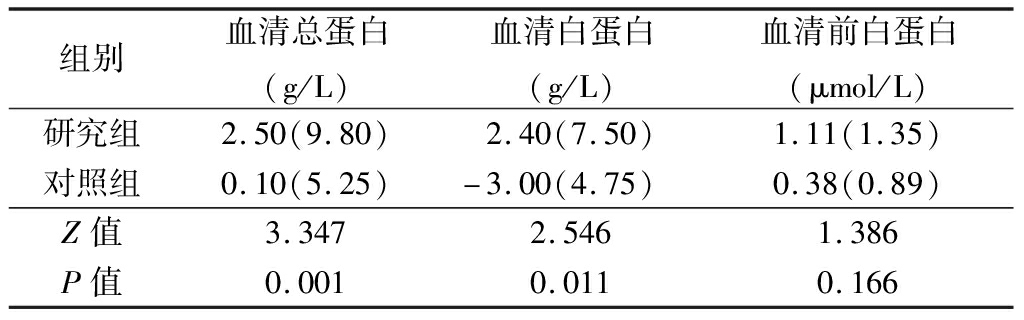
组别血清总蛋白(g/L)血清白蛋白(g/L)血清前白蛋白(μmol/L)研究组2.50(9.80)2.40(7.50)1.11(1.35)对照组0.10(5.25)-3.00(4.75)0.38(0.89)Z值3.3472.5461.386P值0.0010.0110.166
2.4 不良反应的发生率 在治疗期间,研究组恶心或呕吐、Hb减少的发生率明显低于对照组(P<0.05),而两组腹泻、血清总胆红素(total bilirubin,TBIL)升高、ALT/AST升高、WBC降低、血小板计数降低及外周神经毒性的发生率差异无统计学意义(P>0.05)。见表4。
表4 两组治疗期间不良反应的发生率比较 (n=60,例数,%)
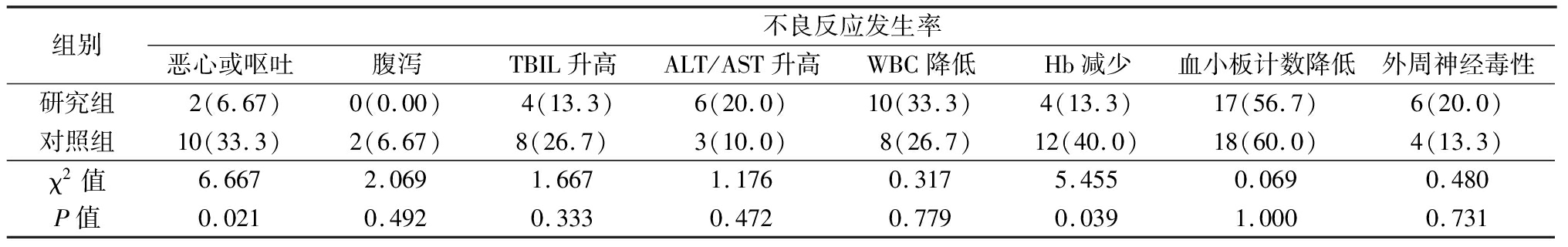
组别不良反应发生率恶心或呕吐腹泻TBIL升高ALT/AST升高WBC降低Hb减少血小板计数降低外周神经毒性研究组2(6.67)0(0.00)4(13.3)6(20.0)10(33.3)4(13.3)17(56.7)6(20.0)对照组10(33.3)2(6.67)8(26.7)3(10.0)8(26.7)12(40.0)18(60.0)4(13.3)χ2值6.6672.0691.6671.1760.3175.4550.0690.480P值0.0210.4920.3330.4720.7790.0391.0000.731
3 讨 论
胃癌是严重影响营养状况的消化道恶性肿瘤之一。新辅助化疗期间发生营养不良的原因包括:疾病本身导致的厌食、化疗药物毒性引起的吸收和消化障碍、机体分解代谢增加等 [12-14]。营养不良会降低患者对化疗的耐受度,致使患者无法完成或提前中止化疗计划,从而影响患者的抗肿瘤治疗效果。因此,合理、有效地提供营养支持对改善肿瘤患者的预后及生活质量具有积极作用。国外多以营养支持小组的形式对患者进行营养支持,而国内尚缺乏系统化的全程营养管理模式。本研究中,经过专业化培训的营养药师与临床医师、专科护士组成营养支持小组,全面参与到全程营养管理的各个环节,充分体现MDT在营养治疗中的优势。
本研究研究组和对照组患者入组时性别、年龄、肿瘤浸润深度、淋巴结转移情况以及营养指标具有可比性,经过两个周期的新辅助化疗后,两组的营养指标有所变化。对照组营养状况下降,而研究组营养状况则较治疗前改善或稳定。体重变化是影响胃癌患者预后的重要因素之一,研究表明体重下降程度与肿瘤进展和患者生存预后有关[15]。由于肿瘤患者机体代谢异常、消化吸收功能受损等导致体重迅速下降,体重变化可以最直观的反映出患者的营养状态。本研究结果显示,两组治疗后与治疗前的体重变化差异有统计学意义(P<0.05)。治疗1个周期后,研究组患者的体重趋于稳定,而对照组体重有所下降;治疗2个周期后,研究组患者体重较治疗前有所增加,对照组患者体重仍持续下降。此外,血清总蛋白、血清白蛋白是反映体内蛋白质消耗以及营养状况最常用的指标,长期营养摄入不足以及消耗过多会导致蛋白质被大量消耗,造成机体处于负氮平衡的状态,血清白蛋白水平与肿瘤患者病死率呈负相关[16-17]。本研究中,给予MDT营养管理能减少患者血清总蛋白和血清白蛋白的丢失,改善患者的营养状态。
卡培他滨联合奥沙利铂和替吉奥联合奥沙利铂是消化道恶性肿瘤患者常用的化疗方案,其引起恶心呕吐的机制是激活消化道及嗜铬细胞释放神经递质5-羟色胺(5-hydroxytryptamine,5-HT),5-HT与5-HT3受体结合后能够经迷走神经将兴奋穿入呕吐中枢、引起恶心呕吐症状[18-19]。恶心呕吐不仅会对患者的营养状况造成影响,还会引起机体的氧化应激反应。本研究中,研究组恶心或呕吐的发生率显著低于对照组(P<0.05)。另外,胃癌患者在治疗期间出现贫血的现象较为常见,主要原因为肿瘤出血及化疗导致的骨髓抑制,贫血是影响化疗疗效和预后的最主要因素[20]。临床上常以Hb水平作为判断贫血的标准,Hb水平能从一定程度上反映患者的营养状态。胃癌患者由于机体营养素的缺乏,如铁、维生素B12、叶酸、维生素A等的缺乏会导致贫血。当机体处于贫血状态时,肠道血运不佳,无法为肠道提供必要的氧气和营养物质,导致消化功能紊乱,进而加重营养不良。本研究结果发现研究组Hb减少的发生率明显低于对照组(P<0.05)。说明该营养管理模式有利于减少化疗相关不良反应的发生,改善患者的生活质量。
综上所述,MDT全程营养管理模式有利于改善胃癌新辅助化疗患者的营养状况,降低化疗不良反应发生率,提高抗肿瘤治疗的耐受程度。因此,推荐MDT参与肿瘤患者的全程营养管理,从而使患者最大程度地耐受抗肿瘤治疗,提高生活质量,改善预后。
[1] Japanese Gastric Cancer Association.Japanese gastric cancer treatment guidelines 2018(5th edition)[J].Gastric Cancer,2021,24(1):1-21.
[2] 张晓杰,赵东兵.局部进展期胃癌新辅助化疗疗效预测进展[J].癌症进展,2021,19(8):761-764.
[3] Ajani JA,D′Amico T,Almhanna K,et al.Gastric cancer,version 3.2016,NCCN clinical practice guidelines in oncology[J].J Natl Compr Canc Netw,2016,14(10):1286-1312.
[4] Dewys WD,Begg C,Lavin PT,et al.Prognostic effect of weight loss prior to chemotherapy in cancer patients.Eastern Cooperative Oncology Group[J].Am J Med,1980,69(4):491-497.
[5] Muscaritoli M,Arends J,Bachmann P,et al.ESPEN practical guideline:Clinical Nutrition in cancer[J].Clin Nutr,2021,40(5):2898-2913.
[6] 吴国豪,曹冬兴,魏嘉,等.恶性肿瘤患者能量、物质代谢及机体组成变化[J].中华外科杂志,2008,46(24):1906-1909.
[7] 李子禹,闫超,李沈.胃癌围手术期营养治疗中国专家共识(2019版)[J].中国实用外科杂志,2020,40(2):145-151.
[8] 吴国豪,谈善军.肿瘤患者营养支持指南[J].中华外科杂志,2017,55(11):801-829.
[9] 吴国豪,谈善军.成人口服营养补充专家共识[J/CD].消化肿瘤杂志(电子版),2017,9(3):151-155.
[10] 中国抗癌协会,中国抗癌协会肿瘤营养与支持治疗专业委员会,中国抗癌协会肿瘤康复与姑息治疗专业委员会,等.化疗患者营养治疗指南[J/CD].肿瘤代谢与营养电子杂志,2016,3(3):158-163.
[11] 石汉平,李苏宜,王昆华,等.胃癌患者营养治疗指南[J/CD].肿瘤代谢与营养电子杂志,2015,2(2):37-40.
[12] Horstman AM,Sheffield-Moore M.Nutrition/metabolic response in older cancer patients[J].Nutrition,2015,31(4):605-607.
[13] Laviano A,Meguid MM,Rossi-Fanelli F.Cancer anorexia:clinical implication,pathogenesis and therapeutics[J].Lancet Oncol,2003,4(11):686-694.
[14] 王新颖,黎介寿.癌性恶病质的代谢改变和营养干预策略[J].肠外与肠内营养,2017,24(1):4-9.
[15] O′Gormann P,McMillan DC,McArdle CS.Impact of weight loss,appetite,and the irdlammatory response on quality of life in gastrointestinal cancer patients[J].Nutr Cancer,1998,32(2):76-80.
[16] Liu BZ,Tao L,Chen YZ,et al.Preoperative body mass index,blood albumin and triglycerides predict survival for patients with gastric cancer[J].PLoS One,2016,11(6):e0157401.
[17] Schindl M,Wigmore SJ,Currie EJ,et al.Prognostic scoring in colorectal cancer liver metastases:development and validation[J].Arch Surg,2005,140(2):183-189.
[18] Goto A,Kotani H,Miyazaki M,et al.Genotype frequencies for polymorphisms related to chemotherapy-induced nausea and vomiting in a Japanese population[J].J Pharm Health Care Sci,2016,21(2):16.
[19] Kiernan J.Genetic Influence on chemotherapy-induced nausea and vomiting:a narrative review[J].Oncol Nurs Forum,2016,43(3):389-393.
[20] Park SH,Lee J,Lee SH,et al.Anemia is the strongest prognostic factor for outcomes of 5-fuorouracil-based first-line chemotherapy in patients with advanced gastric cancer[J].Cancer Chemother Pharmacol,2006,57(1):91-96.