肺炎支原体肺炎主要是由肺炎支原体引发的肺部急性炎症病变,是儿童中较为常见的肺部疾传染病,能够通过呼吸道进行传染,在人群较多的地方,传染率更是高达50%[1]。其主要能够对气道上皮细胞产生黏附作用,造成氧化应激损伤,同时释放CARDS毒素,使气道出现损伤[2]。近年来,随着自然环境的不断变化,使得该病发病率呈上升趋势[3]。该病作为较强的传染性疾病,临床症状较为多变,随着炎症反应的不断加重,不仅会影响到患者呼吸系统,同时易引发脑炎、肾炎及心肌炎等多种疾病[4]。同时,随着病情的加重,可导致多系统功能障碍的出现[5]。甲泼尼龙属于中效的糖皮质激素,其主要作用有稳定细胞膜、促进抗炎、抑制炎症因子的释放[6]。甲泼尼龙应用在肺组织损伤中取得显著效果,但通过建立小鼠模型治疗肺炎支原体肺炎涉及肺组织通路机制的研究,目前尚未见报道。现基于肺炎支原体肺炎模型,分析不同剂量甲泼尼龙应用中对小鼠肺组织Toll样受体4(Toll-like receptor 4,TLR4)/核因子κB(nuclear factor κB ,NF-κB)通路的影响,旨在为临床用药提供依据。
1 材料与方法
1.1 材料 选取40只SD健康雄性小鼠,由吉林大学动物实验中心提供,年龄7~10月,平均(8.5±0.8)月;体重220~234 g,平均(226.9±4.7) g。在环境中相对湿度为50%~55%、温度在(24.1±2.1)℃,对小鼠进行喂养1周,光照时间在12 h/d。
本研究实验动物伦理委员会所批准通过。
实验试剂、甲泼尼龙(NV 公司);兔抗小鼠白细胞介素1β(interleukin-1β,IL-1β)抗体(Hyclone公司);小鼠抗小鼠TLR4、NF-κB抗体(Gibco公司);小鼠抗小鼠超氧化物歧化酶(superoxide dismutase,SOD),硫代巴比妥酸法检测丙二醛(malondialdehyde,MDA)抗体(Sigma公司);小鼠抗兔肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)抗体(Invitrogen公司);正置荧光显微镜(日本Olympas公司)。
1.2 方法
1.2.1 建模及分组 参照蒙艳丽等[7]相关建肺炎支原体模型文献,随机选取10只小鼠作为正常小鼠组,进行滴鼻0.1 mL蒸馏水。其余30只建立肺炎支原体肺炎小鼠模型,以乙醚对全部小鼠进行轻度麻醉,后使用1 mL注射器对小鼠鼻腔进行缓慢滴入1×107 CCU/mL的MP菌液0.1 mL,并连续滴鼻3 d。在造模9 d后,采集小鼠血液进行分离培养及PCR检测肺炎支原体,确认成功建立肺炎支原体模型。其中随机选取10只小鼠为模型组,不做任何处理。其余20只进行甲泼尼龙,分别为低剂量干预组、高剂量干预组。参照宋立成等[8]相关不同剂量甲泼尼龙干预方法对大鼠进行干预,低剂量干预组对小鼠腹腔内进行注射0.4 mg/kg,高剂量干预组于小鼠腹腔内进行注射4 mg/kg。
1.2.2 标本制备 取各组小鼠尾部静脉血2 mL,2 000 r/min离心处理15 min后分离上清液,在-80 ℃环境中保存待检。对各组小鼠进行麻醉处理后,断头法处死,取小鼠颈动脉组织,之后固定在4%甲醛中,完全浸泡,于24 h后行常规石蜡包埋及连续切片。
1.2.3 HE染色 首先将切片烤干,后进行脱蜡处理,按照顺序置入不同浓度的酒精中各进行复水3 min。选择应用苏木精进行15 min染色,然后清洗3次,以盐酸酒精分化进行30 s处理,将其充分清洗后,以1%伊红染色,酒精脱水处理,后脱蜡处理,待封片之后,显微镜观察。
1.2.4 TLR4、NF-κB表达检测 将大鼠均抽取静脉血,并放置在无添加剂真空试管中,在室温下静置30 min,将血液充分凝结。后在低速离心机内,以4 ℃环境下进行2 000 r/min转速离心处理10 min,后以移液器移至1.5 mL无酶EP试管内,使用300 μL的EP管进行分装,保存在-80 ℃冰箱中备用。以RT-PCR对TLR4、NF-κB表达进行检测,首先提取细胞总RNA,检测其RNA纯度、含量,逆转录处理后获得cDNA,设计引物序列,采用2-△△Ct方法计算TLR4、NF-κB表达,PCR引物以Primer Premier 6.0软件进行设计(Invitrogen公司合成)。其中TLR4上引物为5′-TGGTTTACACGTCCA-TCGGT-3′,下游引物为5′-ATCAATGGTCACA-TCACATAGTCC-3′。NF-κB上引物为5′-AAAA-TGCCCCACGGTTATG-3′,下游引物为5′-ATTC-CTTTGCCTCC-3′。
1.2.5 TLR4、NF-κB检测 取小鼠肺部组织进行研磨,采用蛋白裂解液提取总蛋白,以免疫组化法检测TLR4、NF-κB水平,以PBS作为阴性对照,当细胞膜或细胞浆呈棕黄色或棕褐色为CK19染色阳性信号。将组织蜡块进行石蜡切块,将厚度切为4 μm,以常规脱蜡、脱水,进行抗原修复,除去离子水孵化,并滴加TLR4、NF-κB为一抗,在4 ℃置放12 h,进行2次PBS清洗,同时滴加聚合梅辅助剂,在37 ℃下水浴,进行持续孵化,时间为20 min;2次PBS清洗,并进行滴加IgG多聚体。在37 ℃下水浴,进行持续孵化,时间为30 min。后计算出TLR4、NF-κB水平。
1.2.6 TNF-α、IL-1β水平检测 使用酶联免疫法检测TNF-α、IL-1β水平,首先将血清置于室温后,标记酶标板,制作标准品,然后取出试剂盒,选择1∶2稀释液对样品稀释;在反应孔上选择将稀释好的待测血清和标准品100 μL/孔依次加入,在恒温孵育箱中进行湿育2 h,温度为37 ℃;以专用的洗涤液对反应板进行3次清洗,后置入抗体工作液(1∶100倍稀释后),以100 μL/孔,在37 ℃恒温孵育箱内进行湿育45 min;待继续4次清洗反应板后,将反应孔中放入TMB溶液,规格为100 μL/孔,放置在37 ℃恒温孵育箱中进行湿育45 min,后在反应孔中加入终止液100 μL/孔进行终止反应,以450 nm波长测定吸光度,颜色反应深浅与TNF-α、IL-1β水平成正比,经绘制标准曲线计算TNF-α、IL-1β水平。
1.2.7 SOD检测 应用黄嘌呤氧化酶法检测SOD,首先取用聚苯乙烯试管,并分为测量管、对照管。提取样品后,于上清中加蒸馏水,体积是上清的10倍,将样品配制为浓度1%。测量管、对照管内均加1.0 mL试剂盒中的试剂,在试剂1、2、3、4内各加入0.1 mL,然后测量管加入样品50 μL,在对照管内加50 μL蒸馏水,待加样后,将试管放入旋涡混匀器进行充分混匀,在37 ℃恒温水浴箱中存40 min。显色:在对照管、测量管中各加2 mL显色剂,室温放置10 min。使用蒸馏水调零分光光度计算,选择1 cm光径条件下,以波长550 nm比色。
1.2.8 MDA检测 取用聚苯乙烯试管,将其分为标准管、标准空白管及测量管、测量空白管,分别在标准管中加入10 nmol/L四乙氧基丙烷0.1 mL与试剂盒试剂,标准空白管加0.1 mL的无水乙醇与试剂,测量管加入肌肉组织匀浆0.1 mL的上清液与试剂,测量空白管加肌肉组织匀浆0.1 mL的上清液与试剂。加样完毕后,摇动试管架将其混匀,标准管、标准空白管、测量管均置入3 mL的硫代巴比妥酸与1 mL的双蒸水,测量空白管内置入硫代巴比妥酸3 mL与50%冰醋酸 1 mL。所有试管置入旋涡混匀器混匀,将试管口使用用保鲜薄膜扎紧,用针头刺出一个小孔,在95 ℃进行水浴40 min,使用后流水进行冷却,然后在4 ℃,以3 500~4 000 r/min离心处理10 min,将上清液使用移液器吸取,加入比色皿内待检,使用蒸馏水调零分光光度计算出MDA值。
1.3 统计学方法 应用SPSS 21.0统计软件分析数据。计量资料比较采用单因素方差分析检验、SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 HE染色 正常小鼠组肺泡及支气管结构清晰且完整,且未出现肺泡间隔增厚及炎性细胞侵袭;模型组肺泡出现融合、破裂,气管和肺间质被较多淋巴细胞为主的炎症细胞浸润;低剂量干预组肺泡及支气管结构完整,出现炎性细胞浸润以及少量分泌物;高剂量干预组肺泡及支气管结构得到改善较为显著(图1)。
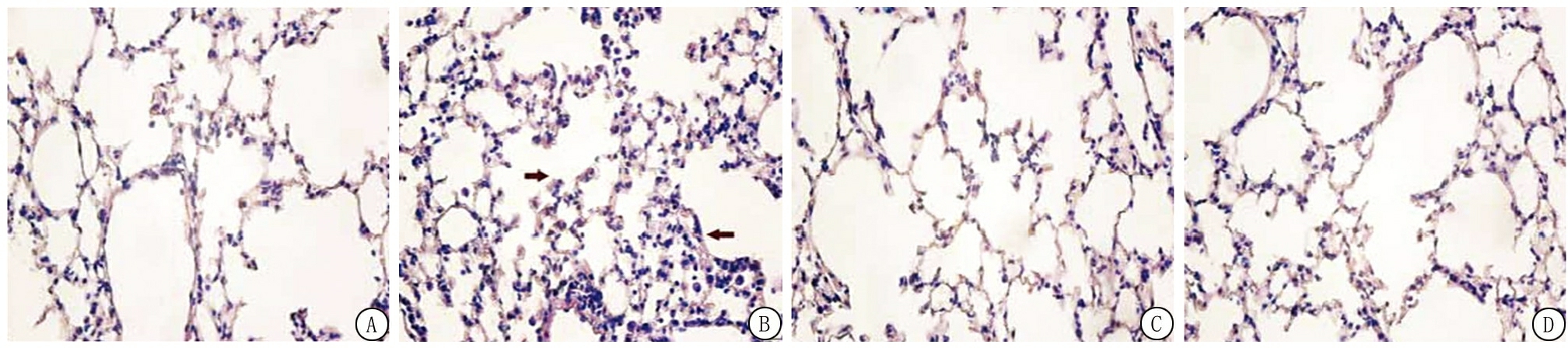
图1 各组间小鼠肺组织病理学变化(HE ×200)
A.正常小鼠组;B. 模型组;C.低剂量干预组;D.高剂量干预组
Figure 1 Pathological changes of lung tissue of mice in each group(HE ×200)
2.2 各组TLR4、NF-κB表达比较 各组间小鼠TLR4、NF-κB表达进行比较,相比正常小鼠组,模型组、低剂量干预组与高剂量干预组TLR4、NF-κB表达均较高,低剂量干预组与高剂量干预组TLR4、NF-κB表达低于模型组,且高剂量干预组TLR4、NF-κB表达低于低剂量干预组,差异有统计学意义(P<0.05)。见表1。
表1 各组TLR4、NF-κB表达比较
Table 1 Comparison of the expression of TLR4 and
NF-κB among groups![]()

组别 TLR4NF-κB正常小鼠组 0.86±0.040.95±0.14模型组 1.97±0.24*2.93±0.27*低剂量干预组1.59±0.14*#2.21±0.35*#高剂量干预组1.03±0.11*#△1.63±0.15*#△F值 21.64030.881P值 <0.001<0.001
*P值<0.05与正常小鼠组比较 #P值<0.05与模型组比较 △P值<0.05与低剂量干预组比较(SNK-q检验)
2.3 TLR4、NF-κB水平比较 相比正常小鼠组,模型组、低剂量干预组与高剂量干预组TLR4、NF-κB水平均较高,低剂量干预组与高剂量干预组TLR4、NF-κB水平低于模型组,且高剂量干预组TLR4、NF-κB水平低于低剂量干预组,差异有统计学意义(P<0.05)。见表2。
表2 各组间TLR4、NF-κB水平比较
Table 2 Comparison of TLR4 and NF-κB
levels among groups![]()

组别 TLR4NF-κB正常小鼠组 20.86±2.346.52±0.74模型组 59.76±6.24*22.53±2.24*低剂量干预组45.79±4.32*#18.71±1.83*#高剂量干预组32.41±3.53*#△14.75±1.75*#△F值 27.68832.192P值 <0.001<0.001
*P值<0.05与正常小鼠组比较 #P值<0.05与模型组比较 △P值<0.05与低剂量干预组比较(SNK-q检验)
2.4 TNF-α、IL-1β水平比较 相比正常小鼠组,模型组、低剂量干预组与高剂量干预组TNF-α、IL-1β水平均较高,低剂量干预组与高剂量干预组TNF-α、IL-1β水平低于模型组,且高剂量干预组TNF-α、IL-1β水平低于低剂量干预组,差异有统计学意义(P<0.05)。见表3。
表3 各组间小鼠TNF-α、LI-1β水平进行比较
Table 3 Comparison of the levels of TNF-α and
LI-1β among groups![]()
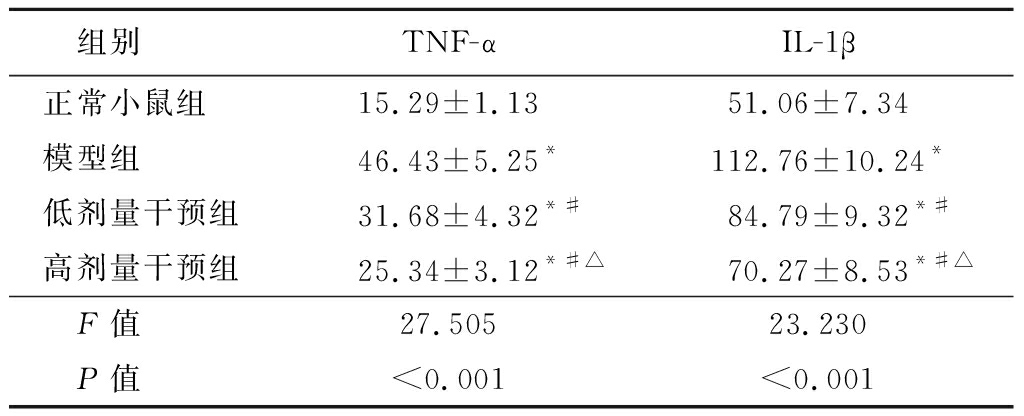
组别 TNF-αIL-1β正常小鼠组 15.29±1.1351.06±7.34模型组 46.43±5.25*112.76±10.24*低剂量干预组31.68±4.32*#84.79±9.32*#高剂量干预组25.34±3.12*#△70.27±8.53*#△F值 27.50523.230P值 <0.001<0.001
*P值<0.05与正常小鼠组比较 #P值<0.05与模型组比较 △P值<0.05与低剂量干预组比较(SNK-q检验)
2.5 MDA、SOD水平比较 相比正常小鼠组,模型组、低剂量干预组与高剂量干预组MDA水平较高、SOD水平均较低,低剂量干预组与高剂量干预组MDA水平低于、SOD水平高于模型组,且高剂量干预组MDA水平低于、SOD水平高于低剂量干预组,差异有统计学意义(P<0.05)。见表4。
表4 各组间小鼠MDA、SOD水平进行比较
Table 4 Comparison of the levels of MDA and
SOD of mice in each group![]()

组别 MDA(μmol/L)SOD(kU/L)正常小鼠组 30.29±5.1336.06±3.74模型组 236.43±21.25*12.76±1.24*低剂量干预组171.68±19.32*#20.79±2.32*#高剂量干预组142.00±15.53*#△27.52±3.57*#△F值 44.73028.050P值 <0.001<0.001
*P值<0.05与正常小鼠组比较 #P值<0.05与模型组比较 △P值<0.05与低剂量干预组比较(SNK-q检验)
3 讨 论
当肺炎支原体造成肺部急性炎症病变即肺炎支原体肺炎,是儿童人群中较为常见的一种肺炎,近年来其发病率有着明显的升高的趋势[8]。肺炎支原体肺炎具有较高的传染性,主要通过呼吸道进行传染,经血液流经全身[9]。在较多人群中,传染率高达50%。在肺炎支原体肺炎中,当大量炎症因子的释放,进而使患者病情加重,病死率得到提升[10]。多数学者研究表明,TLR4/NF-κB是较为经典的信号传导通路,在炎症反应与氧化应激中均发挥重要作用[11]。TLR4能够激活NF-κB进而使炎症因子的释放,当TLR4介导信号通路激发炎症反应,进而造成炎症与抗炎症反应失衡及组织损伤。在肺炎中,糖皮质激素能够有效抑制炎症反应。甲泼尼龙属于一类中效糖皮质激素,具有稳定细胞膜、抗炎及非特异性免疫抑制的作用[12]。能够有效做到消除肺间质水肿,同时能够减轻肺组织细胞的凋亡。
Toll样受体作为一类的跨细胞膜受体蛋白。其能够识别病原体相关分子模式,同时引发信号传导,并使得炎症介质释放[13]。目前,在Toll样受体中共发现13个,其中TLR4在单核细胞、巨噬细胞以及淋巴细胞等广泛分布。在肺炎中,TLR4呈高表达状态,当NF-κB被TLR4所激活,对组织造成严重损伤,是出现死亡的主要原因[14]。在炎症反应与氧化应激中TLR4/NF-κB信号传导通路过表达发挥重要作用。相关研究显示,TLR4单克隆抗体能够明显减轻小鼠肺部损伤,通过干预TLR4信号通路,能够有效减轻炎症反应[15]。本研究结果显示,应用甲泼尼龙对肺炎支原体肺炎模型小鼠进行干预,TLR4、NF-κB表达较低,且高剂量效果较为显著,说明在肺炎支原体肺炎模型小鼠应用甲泼尼龙,抑制TLR4/NF-κB通路表达,显著改善肺组织损伤。
在肺炎支原体肺炎中,炎症反应在其中发挥重要作用。TNF-α能够诱导并放大炎症反应,当细胞接受到炎症信号,TNF-α会迅速得到释放[16]。相关研究显示,当TNF-α初次释放,能够与其他炎症细胞结合,进而启动机体内免疫应激;当TNF-α再次释放,正反馈放大炎症反应,能够促进其他炎症因子的生成与释放[17]。IL-1β属于一类较为重要的促炎因子,能够与IL-1RI受体结合,进一步造成NF-κB的下游活化[18]。同时能够导致TNF-α分泌上升,进而诱导一系列炎症相关分子的表达。相关研究显示,通过对IL-1β信号传导的阻断,其他炎性因子的效应能够有效得到改善[19]。本研究结果显示,应用甲泼尼龙对肺炎支原体肺炎模型小鼠进行干预,TNF-α、IL-1β水平较低,且高剂量效果较为显著,说明在肺炎支原体肺炎模型小鼠应用甲泼尼龙,抑制炎症反应较为显著。
氧化应激在疾病进展中发挥重要的作用。当机体被病原体入侵,能够直接造成呼吸道上皮细胞与黏膜损伤,进而使氧自由基增多,能够导致机体氧化/抗氧化出现失衡,进而引发氧化应激的发生[20]。SOD是生物体内较为主要的自由基清除剂,能够使超氧阴离子歧化成过氧化氢,在氧化物水解酶作用下成为水分子,具有清除多种来源自由基,并对机体发挥保护的作用[21]。MDA属于脂质过氧化物所分解的一种产物,其水平能够反映机体细胞因自由基产生的损伤程度,对MDA相关测定能够得知脂质过氧化水平[22]。本研究结果显示,应用甲泼尼龙对肺炎支原体肺炎模型小鼠进行干预,MDA水平较低、SOD水平较高,且高剂量效果较为显著,说明在肺炎支原体肺炎模型小鼠应用甲泼尼龙,显著改善氧化应激。
综上所述,在肺炎支原体肺炎模型小鼠中,应用甲泼尼龙能够显著改善出现的肺组织损伤,抑制TLR4/NF-κB通路表达,降低炎症反应程度,改善氧化应激,且高剂量效果较为显著。
[1] Lei X,Zhou W,Chen Z,et al. High expression of HMGB1 in children with refractory Mycoplasma pneumoniae pneumonia[J]. BMC Infect Dis,2018,18(1):439.
[2] 王琳.肺炎支原体肺炎患儿肺炎支原体免疫球蛋白M抗体阳性显现时间的意义分析[J].中国现代药物应用,2020,14(16):54-56.
[3] Kang HM,Yang EA,Lee KY,et al. Epidemiological relationship between Mycoplasma pneumoniae pneumonia and recurrent wheezing episode in children:an observational study at a single hospital in Korea[J]. BMJ Open,2019,9(4):e026461.
[4] Yoshioka M,Horino A,Kenri T,et al. Hokkaido Pediatric Respiratory Infection Study Group. Therapeutic efficacy of azithromycin,clarithromycin,minocycline and tosufloxacin against macrolide-resistant and macrolide-sensitive Mycoplasma pneumoniae pneumonia in pediatric patients[J]. PLoS One,2017,12(3):e0173635.
[5] 肖爱菊,王团结,吴湘涛,等.纤支镜支气管灌洗对儿童难治性肺炎支原体肺炎临床症状、炎症因子水平的影响[J].罕少疾病杂志,2020,27(3):7-8,54.
[6] 张贺,刘晓萌,宋义琴,等.甲泼尼龙辅助治疗儿童肺炎支原体感染性大叶性肺炎疗效与安全性分析[J].新医学,2020,51(8):624-627.
[7] 蒙艳丽,徐慧星,王晓溪,等.慢性肺部炎症合并肺炎支原体肺炎小鼠模型的建立[J].实验动物科学,2020,37(1):22-26.
[8] 宋立成,韩志海,程浩,等.不同剂量甲泼尼龙对烟雾吸入性急性肺损伤大鼠的治疗作用[J].中华危重病急救医学,2018,30(8):754-759.
[9] Xu JJ,Shu LH. Clinical characteristics of refractory mycoplasma pneumoniae pneumonia in children[J]. Zhongguo Dang Dai Er Ke Za Zhi,2018,20(1):37-42.
[10] Zhai J,Liu J,Huang B,et al. Refractory mycoplasma pneumoniae pneumonia with concomitant acute cerebral infarction in a child:A case report and literature review[J]. Medicine(Baltimore),2018,97(13):e0103.
[11] 亢瑞娜,何国莉,黄靓妹,等.穿心莲内酯对克雷伯杆菌肺炎大鼠肺脏病理损伤、免疫功能紊乱及TLR4/NF-κB信号通路的调节作用[J].中国免疫学杂志,2020,36(12):1453-1456,1461.
[12] 王晓昆.甲泼尼龙在儿童肺炎支原体肺炎中的应用[J].中国保健营养,2020,30(18):267.
[13] 潘慧,王晨岑,朱莉莉.支气管哮喘合并感染性肺炎患儿中性粒细胞CD64及Toll样受体的表达及临床意义[J].中国妇幼保健,2019,34(21):4932-4935.
[14] 李莲梅,余博文,毕建朋,等.TLR4对肺炎链球菌诱导的A549细胞凋亡的影响[J].郑州大学学报(医学版),2019,54(1):73-77.
[15] 张新黎,郭昌云.重症肺炎患者炎症因子水平和TLR2、TLR4的关系研究[J].解放军预防医学杂志,2019,37(2):114-115.
[16] 李天萍,黄霞飞,杨蕉,等.呼吸道合胞病毒感染性肺炎患儿的TNF-α 和IL-1β水平及TLR4信号通路作用初步探究[J].中华医院感染学杂志,2020,30(6):919-922.
[17] 郭锦均,梁木华,郑燕冰,等.肺炎支原体肺炎患儿血清IL-6,IL-8,IFN-γ和TNF-α水平及其临床价值[J].岭南急诊医学杂志,2020,25(2):175-177.
[18] Huang P,Lin ZQ,Chen L,et al. Clinical features and treatment of macrolide-resistant Mycoplasma pneumoniae pneumonia in children[J]. Zhongguo Dang Dai Er Ke Za Zhi,2018,20(8):629-634.
[19] 王子,王雪峰,吴振起.清肺透邪汤介导NLRP3炎性小体抑制NF-κB信号通路改善肺炎支原体小鼠炎性反应[J].中国实验动物学报,2020,28(4):470-477.
[20] 孟湘禄.玉屏风散联合阿奇霉素对支原体肺炎患儿心肌酶谱及氧化应激反应的影响[J].中国医学创新,2020,17(20):27-30.
[21] 宋博今.布地奈德联合盐酸氨溴索雾化吸入对150例支气管肺炎患儿血清IL-8、SOD、IGF-Ⅱ水平的影响[J].罕少疾病杂志,2020,27(3):16-18.
[22] 曾雪华,祁永健,吕晓静.低分子肝素对重症肺炎患者凝血功能、免疫功能及抗氧化水平的影响[J].中国医院用药评价与分析,2020,20(1):60-62,65.