室性期前收缩(premature ventruicular contraction,PVC)是一种临床上发病率较高的室性心律失常疾病,可以引发心肌功能障碍和左心房的改变[1],严重影响人们的身体健康及生活质量。研究显示,导管射频消融术(radio-frequeney catheter ablation,RFCA)成功治疗PVC后可使患者心室收缩及舒张功能得到显著改善[2],并且一定程度上可以改善左心房功能及逆向改善左心房重构[3],但对右心房功能及结构的影响尚不清晰。张艳等[4]前期研究发现,右心室来源的频发PVC经RFCA后1个月,左心房功能可以可到明显改善。赵彦蕾等[5]研究进一步表明,来源于右心室流出道间隔部游离壁的PVC经RFCA治疗的效果要优于来源于主动脉窦上及主动脉窦下的PVC。血浆脑钠肽(brain natriuretic peptide,BNP)是反映左心室射血分数(left ventricular ejection fraction,LVEF)及左心室舒张、收缩末期容积的独立指标,可以有效地评价心脏功能受损程度及其预后[6];目前以BNP来评价正常心脏形态的频发PVC患者RFCA术前、后心功能变化较少。本研究则在上述二者前期研究的基础上延长观察时间,并加入右心房射血分数(right atrial ejection fraction,RAEF)、心房病变等心脏超声指标以及血浆BNP指标,以期发现PVC患者RFCA前后全心房变化,通过对比手术前后血浆BNP水平的变化来说明PVC对心功能的影响及BNP的检测意义。
1 资料与方法
1.1 一般资料 选取2018年3月—2019年11月因PVC于河北医科大学第二医院住院拟行RFCA患者共62例,其中男性25例,女性37例。依据术中PVC定位将入选的62例患者分为两组,即A组左心室来源组23例(中位年龄51岁,男性14例)及B组右心室来源组39例(中位年龄49岁,男性11例)。两组性别、年龄及PVC次数比较差异均无统计学意义(P>0.05),具有可比性。
1.2 纳入标准及排除标准 纳入标准:①符合WHO关于PVC的明确诊断标准[7];②24 h的PVC负荷量>10%;③均成功进行了RFCA手术。排除标准:①合并冠心病、心肌病、风心病等器质性心脏疾病;②合并心房颤动、房室传导阻滞等其他心律失常病史;③感染、自身免疫性疾病、甲状腺功能亢进、甲状腺功能减退者及严重心、肝、肾功能不全者。
1.3 治疗方法 所有患者均由同一术者于Carto三维电解剖表测系统引导下采用激动标测与起搏标测相结合的方式对室性期前收缩起源位置进行精准定位并消融。
1.4 观察指标 采取调查问卷方式对所有入选患者进行病史收集,停用抗心律失常药物2周并完善相关检查。所有患者分别于术前和术后1 d、术后1、3、9个月,采用超声心动图二维斑点追踪技术观察左、右心房功能及结构等指标并同步测定血浆BNP水平。通过症状及以上时间点动态心电图判断是否复发。
1.5 心脏超声心动图检查 图像采集:采用配有QLAB图像分析功能的Philips IE 33彩色多普勒超声显像仪,具有脱机存储动态图像并自动分析心房二维斑点追踪成像技术,配备S5-1探头,频率1~5 MHz完成心脏超声指标收集。常规测量左心房内径(left atrial diameter,LAD)、E峰、A峰、E/A值、左心室舒张末期左心房最小容积(left atrial minimal volume,LAVmin)、左心室收缩末期左心房的最大容积(left atrial maximum volume,LAVmax)以及右心室舒张末期右心房最小容积(right atrial minimal volume,RAVmin)、右心室收缩末期右心房的最大容积(right atrial maximum volume,RAVmax),计算右心房射血分数[RAEF=(RAVmax-RAVmin)/RAVmax×100%],同理得出左心房射血分数(left atrial ejection fraction,LAEF)。应用QLAB9.0软件中的CMQ分析程序对已储存的心尖四腔观及二腔观图像进行心肌运动分析,分别将取样点置于左心房及右心房的侧壁、间隔侧、心房顶获取四腔的应变率曲线;再将取样点分别置于心房的下壁、前壁及心房顶获取二腔的应变率曲线,分别获取左、右心房应变(strain,S)和左、右心房舒张早期(e)、舒张晚期(a)和收缩期(s)应变率(strain rate,SR)的平均值。所有超声相关指标均由同一经验丰富的医师连续测量4个窦性心动周期后取平均值所得。
1.6 BNP检测 BNP检测仪器为美国BIOSITE公司制造的TRIAGE快速定量检测仪,一次性加样2.5 mL全血,严格按照操作说明进行操作,15 min测定完毕,有效检测范围为5~5 000 μg/L。
1.7 统计学方法 应用SPSS 26.0统计软件分析数据。计量资料比较采用重复测量数据的方差分析。P<0.05为差异有统计学意义。
2 结 果
左、右心室来源组LAEF、RAEF、左心房S、右心房S等指标呈普遍上升趋势,左心室来源组的LAD术后1个月、左心房SRs术后1 d以及右心室来源组的右心房SRe、SRa术后1 d略有降低,总体呈波动上升趋势,组间差异仅右心房SRe差异有统计学意义(P<0.05);时点间各项差异均有统计学意义(P<0.05);组间·时点间仅左心房SRs、左心房SRa差异有统计学意义(P<0.05)。两组患者BNP水平术后均较术前明显降低,均呈下降趋势,但仅时点间差异有统计学意义(P<0.05)。见表1。
表1 两组各项指标比较
Table 1 Comparison of various indicators between two groups![]()
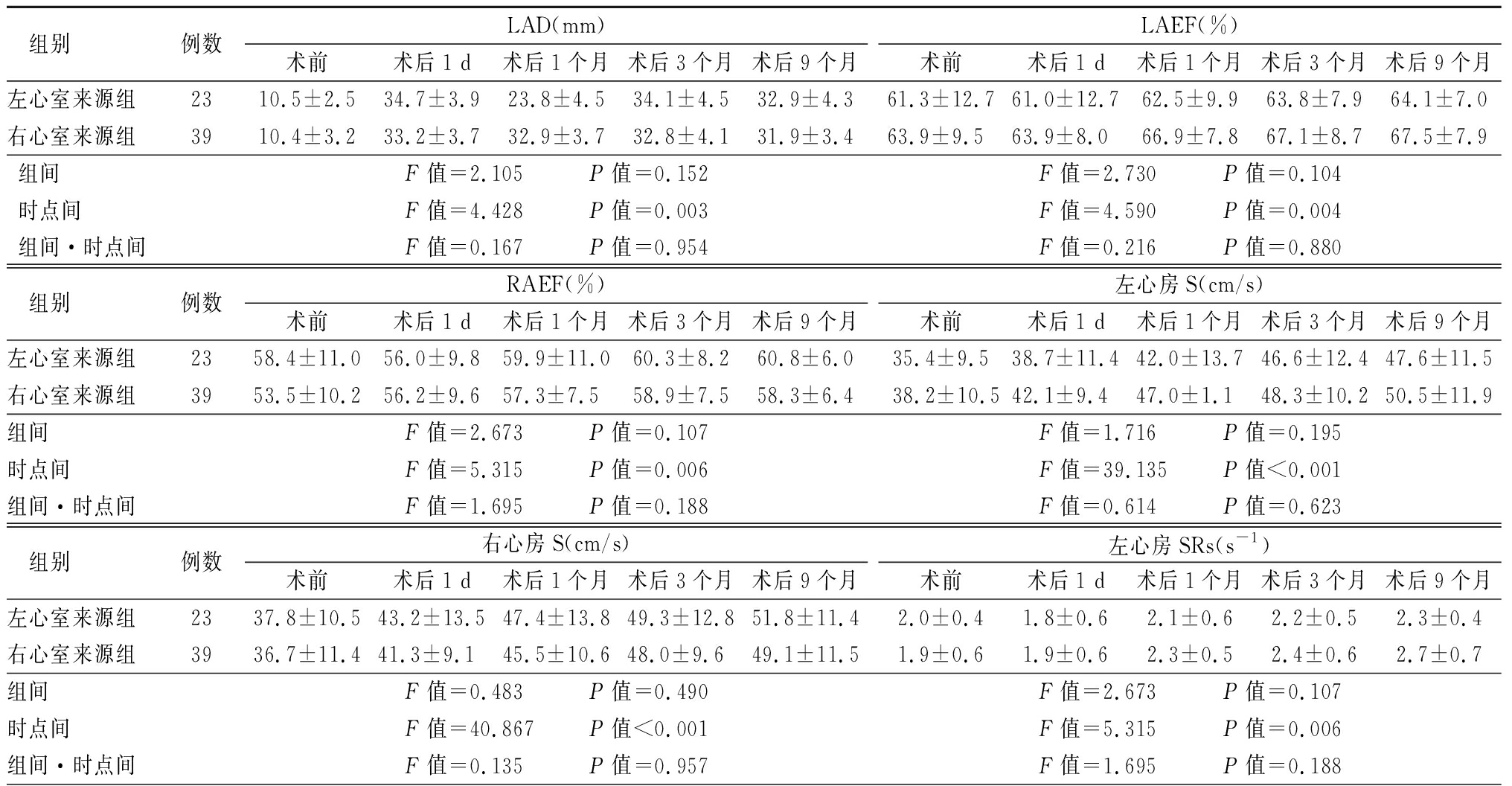
组别 例数LAD(mm)术前术后1 d术后1个月术后3个月术后9个月LAEF(%)术前术后1 d术后1个月术后3个月术后9个月左心室来源组2310.5±2.534.7±3.923.8±4.534.1±4.532.9±4.361.3±12.761.0±12.762.5±9.963.8±7.964.1±7.0右心室来源组3910.4±3.233.2±3.732.9±3.732.8±4.131.9±3.463.9±9.563.9±8.066.9±7.867.1±8.767.5±7.9组间F值=2.105 P值=0.152F值=2.730 P值=0.104时点间F值=4.428 P值=0.003F值=4.590 P值=0.004组间·时点间F值=0.167 P值=0.954F值=0.216 P值=0.880 组别 例数RAEF(%)术前术后1 d术后1个月术后3个月术后9个月左心房S(cm/s)术前术后1 d术后1个月术后3个月术后9个月左心室来源组2358.4±11.056.0±9.859.9±11.060.3±8.260.8±6.035.4±9.538.7±11.442.0±13.746.6±12.447.6±11.5右心室来源组3953.5±10.256.2±9.657.3±7.558.9±7.558.3±6.438.2±10.542.1±9.447.0±1.148.3±10.250.5±11.9组间F值=2.673 P值=0.107F值=1.716 P值=0.195时点间F值=5.315 P值=0.006F值=39.135 P值<0.001组间·时点间F值=1.695 P值=0.188F值=0.614 P值=0.623 组别 例数右心房S(cm/s)术前术后1 d术后1个月术后3个月术后9个月左心房SRs(s-1)术前术后1 d术后1个月术后3个月术后9个月左心室来源组2337.8±10.543.2±13.547.4±13.849.3±12.851.8±11.42.0±0.41.8±0.62.1±0.62.2±0.52.3±0.4右心室来源组3936.7±11.441.3±9.145.5±10.648.0±9.649.1±11.51.9±0.61.9±0.62.3±0.52.4±0.62.7±0.7组间 F值=0.483 P值=0.490F值=2.673 P值=0.107时点间F值=40.867 P值<0.001F值=5.315 P值=0.006组间·时点间F值=0.135 P值=0.957F值=1.695 P值=0.188
表1 (续)
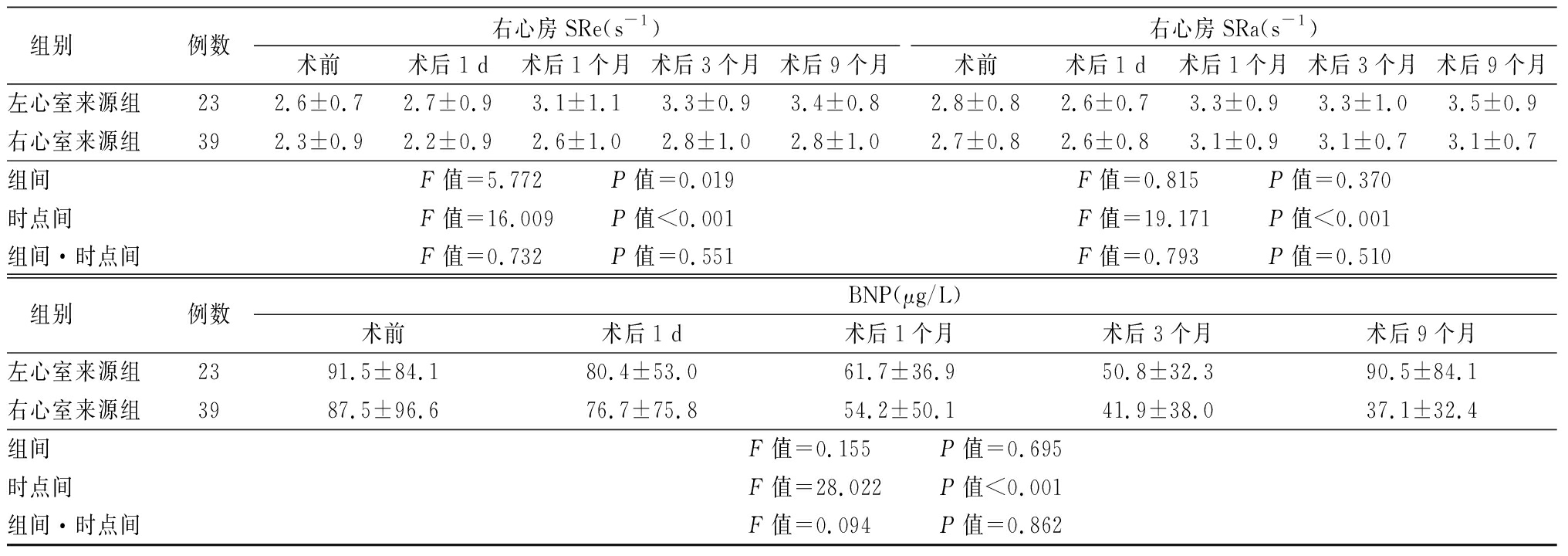
组别例数右心房SRe(s-1)术前术后1 d术后1个月术后3个月术后9个月右心房SRa(s-1)术前术后1 d术后1个月术后3个月术后9个月左心室来源组232.6±0.72.7±0.93.1±1.13.3±0.93.4±0.82.8±0.82.6±0.73.3±0.93.3±1.03.5±0.9右心室来源组392.3±0.92.2±0.92.6±1.02.8±1.02.8±1.02.7±0.82.6±0.83.1±0.93.1±0.73.1±0.7组间F值=5.772 P值=0.019F值=0.815 P值=0.370时点间F值=16.009 P值<0.001F值=19.171 P值<0.001组间·时点间F值=0.732 P值=0.551F值=0.793 P值=0.510 组别例数BNP(μg/L)术前术后1 d术后1个月术后3个月术后9个月左心室来源组2391.5±84.180.4±53.061.7±36.950.8±32.390.5±84.1右心室来源组3987.5±96.676.7±75.854.2±50.141.9±38.037.1±32.4组间F值=0.155 P值=0.695时点间F值=28.022 P值<0.001组间·时点间F值=0.094 P值=0.862
3 讨 论
PVC是最常见的心律失常之一,可见于无器质性心脏病的正常人中,因较少导致恶性事件且常缺乏主观症状曾被广泛认为是良性疾病[8],然而随着近年来关于PVC研究的增加,广泛认为PVC不但可触发遗传性心律失常导致致命性心律失常的发生[9],还可以导致心脏的形态及结构发生变化。有研究表明成功经RFCA治疗PVC后[10-11],不仅左心室功能可得到改善,左心房容积也可以得到恢复。而对于不同来源的频发PVC造成的影响,张艳等[4]研究显示起源于右心室的PVC较起源于左心室的PVC经RFCA术治疗后的左心房结构和功能得到更明显的改善;赵彦蕾等[5]进一步研究发现不同来源PVC成功行RFCA术后以右心室流出道间隔部来源组患者左心房结构和功能改善最显著。
本研究PVC患者左、右心室来源组LAD术后明显升高;右心室来源组LAEF术后1~9个月均较术前明显升高,且时点间差异有统计学意义(P<0.05);提示PVC可能影响患者的左心房结构、功能,而RFCA可明显改善患者左心房结构。两患者组内术后各时间段左心房应变指标均较术前显著升高,且右心室来源组左心房S、SRe、SRa明显高于左心室来源组,虽然“组间”差异均无统计学意义,考虑为左心室来源组样本量小所致,提示右心室来源组左心房功能恢复较左心室来源组明显,左心室来源组右心房功能恢复较右心室来源组明显。与Munetsugu等[12]及张艳等[4]研究得出结论相似。
本研究中两组术前RAEF均较术后减小,术后呈升高趋势,术前右心房排空能力明显减弱,提示特发性PVC对患者的右心房功能产生一定影响,经RFCA手术可改善右心房功能。分析右心房功能受损原因可能与上述左心房排空功能下降原因相似:与窦性心律相较,PVC是心肌电传导与机械运动不同步所致,可使PR间期延长,导致心房压力超负荷,心房功能下降。两治疗组术前右心房应变均较对照组降低,术后1 d~术后9个月逐渐升高,且均明显高于术前,且两组比较,右心室来源组各应变指标多大于左心室来源组,提示左心室来源组较右心室来源组右心房功能恢复明显,右心室来源组较左心室来源组左心房功能恢复明显。分析原因为左心室来源的PVC多表现为右束支传导阻滞,使右心室内压力明显增高,较左心室起源的PVC更易致使右心房结构和功能障碍,RFCA术后PVC消失,右心房压力负荷减小,致使左心室来源组患者右心房功能恢复较右心室来源组明显;而右心室来源的PVC多表现为左束支传导阻滞,同理可推论。
BNP即脑钠肽,又称B型钠尿肽,素有心力衰竭的“白细胞计数”之称,也是反映左心室容积、压力及射血分数的最重要独立指标[13]。研究显示,血浆BNP浓度对于诊断慢性心力衰竭具有高敏感度及特异度,并且在诊断早期心力衰竭方面,血浆BNP水平的检测比超声心动图的检查更加方便、快捷[14]。本研究中左、右心室来源组PVC患者术后1~9个月 BNP较术前有显著下降趋势,提示频发PVC患者行RFCA治疗后BNP水平显著下降,心室功能较前改善,与Miake等[15]和Deng等 [16]研究得出结果相似。
PVC影响心功能的机制尚不完全明确,有文献显示,其影响心功能的机制与心室不同步收缩进而导致慢性左心功能减退相似[17];而有研究显示[18],PVC时的左束支激动模式是导致心功能障碍的重要可逆性因素,指出双室不同步收缩可能是引起PVC心功能障碍的重要原因之一。有文献显示,一次PVC减少心脏做功9%[19];根据上述,多种因素可综合导致血流动力学紊乱引起心功能受损,若未及时给予干预可致机体失代偿。而在PVC未导致心脏结构或功能发生改变前,机体便启动运行神经体液调节机制给予代偿,心室肌分泌BNP会因心肌结构改变逐渐增多,进而通过其拮抗肾素-血管紧张素-醛固酮系统的能力使心室重构速度减缓,因BNP有扩血管、减少钠水潴留等功能,可以有效减轻心脏负担,故由于此代偿机制,BNP分泌量在频发PVC患者心功能受损的早期就可高于健康人群。鉴于BNP可以早期、敏感地评价心脏功能,基于此研究,可以推测,早期及时联合应用BNP指标可以大致判断出PVC患者病情的严重程度、发展及预后,借此可以及早发现患者心功能受损的倾向并及时进行早期干预,避免心功能及结构的进一步损害。
本研究中不足之处在于样本量较少,并且对特发性PVC起源的分类不够细致,仅能反映一种趋势,导致许多观察指标无统计学意义,后期可进一步积攒扩大样本量以期作进一步分析。
[1] Gunda S,Akyeampong D,Gomez-Arroyo J,et al. Consequences of chronic frequent premature atrial contractions:association with cardiac arrhythmias and cardiac structural changes[J]. J Cardiovasc Electrophysiol,2019,30(10):1952-1959.
[2] Tanaka A,Takemoto M,Masumoto A,et al . Radiofrequency catheter ablation of premature ventricular contractions from near the His-bundle [J]. J Arrhythm,2019,35(2):252-261.
[3] 李永豪,王卓清,龚积艳,等.无创血流动力学检测评价特发性室性期前收缩患者经导管射频消融术前后心功能变化的临床研究[J].军事医学,2017,41(5):402-405.
[4] 张艳,谢瑞芹,白晖,等.不同来源频发室性早搏射频消融前后左心房功能变化[J].中华心律失常学,2017,20(3):213-218.
[5] 赵彦蕾,张艳,吴敬兰,等.不同起源部位频发室性期前收缩射频消融术对左心房结构及功能的影响[J].临床心血管病,2019,35(8):746-751.
[6] 邸玉青.血浆脑钠肽和超声心动图在评估慢性心力衰竭患者心功能中的临床价值分析[J].中国临床医生,2018,46(4):399-402.
[7] 侯军龙,魏亚静.冷冻球囊消融术与射频消融术治疗心房颤动有效性和安全性的比较研究[J].实用心脑肺血管病,2016,24(1):111-114.
[8] Hsu JJ,Nsair A,Aboulhosn JA,et al. Monomorphic ventricular arrhythmias in athletes[J]. Arrhythm Electrophysiol Rev,2019,8(2):83-89.
[9] Kobayashi Y. Idiopathic ventricular premature contraction and ventricular tachycardia: distribution of the origin,diagnostic algorithm,and catheter ablation[J]. J Nippon Med Sch,2018,85(2):87-94.
[10] Kanat S,Karaduman BD,Tütüncü A,et al. Effect of echocardiographic epicardial adipose tissue thickness on success rates of premature ventricular contraction ablation[J] Balkan Med J,2019,36(6):324-330.
[11] Hwang J,Park HS,Han S,et al. The impact of catheter ablation of atrial fibrillation on the left atrial volume and function: study using three-dimensional echocardiography[J]. J Interv Card Electrophysiol,2020,57(1):87-95.
[12] Munetsugu Y,Kawamura M,Gokan T,et al. J-Wave elevation in the inferior leads predicts lethal ventricular arrhythmia initiated by premature ventricular contractions with right bundle branch block and superior axis[J]. Circ J,2019,83(9):1851-1859.
[13] Kitada S,Kikuchi S,Tsujino T,et al. The prognostic value of brain natriuretic peptide in patients with heart failure and left ventricular ejection fraction higher than 60%: a sub-analysis of the J-MELODIC study[J]. ESC Heart Fail,2018,5(1):36-45.
[14] Yoshida Y,Nakanishi K,Daimon M,et al. Alteration of cardiac performance and serum B-type Natriuretic peptide level in healthy aging[J] . J Am Coll Cardiol,2019,74(14):1789-1800.
[15] Miake J,Kato M,Ogura K,et al. Pre-ablation levels of brain natriuretic peptide are independently associated with the recurrence of atrial fibrillation after radiofrequency catheter ablation in patients with nonvalvular atrial fibrillation[J]. Heart Vessels,2019,34(3):517-526.
[16] Deng H,Shantsila A,Guo P,et al. Multiple biomarkers and arrhythmia outcome following catheter ablation of atrial fibrillation:the guangzhou atrial fibrillation project[J]. J Arrhythm,2018,34(6):617-625.
[17] Kanat A,Mutluer FO,Tütüncü A,et al. Left atrial function is improved in short-term follow-up after catheter ablation of outflow tract premature ventricular complexes[J]. Medicina(Kaunas),2019,55(6):241.
[18] Walters TE,Rahmutula D,Szilagyi J,et al. Left ventricular dyssynchrony predicts the cardiomyopathy associated with premature ventricular contractions[J]. J Am Coll Cardiol,2018,72(23 Pt A):2870-2882.
[19] Robinson CG,Samson PP,Moore KMS,et al. Phase Ⅰ/Ⅱ trial of electrophysiology-guided noninvasive cardiac radioablation for ventricular tachycardia[J]. Circulation,2019,139(3):313-321.