血尿酸(serum uric acid,SUA)是嘌呤代谢的终产物,人体内生成的SUA仅有1/3来源于摄取的食物嘌呤,而剩余的2/3来源于嘌呤核苷酸的代谢;提示体内SUA的代谢过程较饮食摄入发挥更重要的作用[1]。体内SUA浓度受尿酸盐生成和排泄的平衡控制,高尿酸血症(hyperuricemia,HUA)是尿酸盐生成增多或排泄减少而引起的嘌呤代谢紊乱导致出现的代谢异常综合,是引发糖耐量异常、氧化应激、慢性炎症反应及胰岛素抵抗的重要危险因素[2]。HUA与2型糖尿病(type 2 diabetes mellitus,T2DM)紧密联系[3],T2DM患者的SUA水平明显高于正常健康对照组[4]。目前对无症状HUA患者使用降尿酸药物治疗的风险/效益比尚不清楚,因此,对于T2DM患者可选择对降SUA作用可能有额外效益的降糖药物。因此本研究旨在评估口服单种降糖药物的T2DM患者不同SUA水平状态下糖脂代谢及降糖药物的差异。
1 资料与方法
1.1 一般资料 选取2019年3月—2020年5月在秦皇岛军工医院门诊就诊的T2DM患者。纳入标准:①符合1999年WHO糖尿病诊断标准的T2DM患者;②口服单种降糖药物(达格列净、二甲双胍、阿卡波糖、格列喹酮、维格列汀);③有SUA检测数据(非同日2次)且无痛风史;④既往未诊断高血压病、高脂血症、冠心病、脑血管病等疾病,近期未服用相关药物者;⑤无酗酒史,近期无影响血糖、SUA的因素存在。最终选取912例作为研究对象。根据SUA水平分为单纯糖尿病组(NUA组,n=741)和糖尿病合并HUA组(HUA组,n=171)。
本研究经医院伦理委员会审核通过,所有患者均签署知情同意书。
1.2 方法 记录每位患者的人口学信息、糖尿病病程、T2DM家族史、目前口服降糖药物、HUA家族史、吸烟(≥1支/d,持续≥1年)、饮酒(折合乙醇量男性>140 g/周,女性>70 g/周),测量身高、体重,计算体重指数(body mass index,BMI);测量收缩压(systolic blood pressure,SBP)、舒张压(systolic blood pressure,DBP)。空腹8~10 h,于次日晨抽取肘静脉血,检测糖化血红蛋白(hemoglobin A1c,HbA1c)、三酰甘油(triacylgycerol,TG)、低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol,LDL-C)、总胆固醇(total cholestero,TC)、高密度脂蛋白胆固醇(high-density lipoprotein-cholesterol,HDL-C)、SUA、肌酐(creatinine,Cr)、尿素氮(blood urea nitrogen,BUN)。生化室Hitachi LST008生化仪检测各项生化指标,采用亲和层析高压液相方法检测HbA1c(Premier Hb9210)。
HUA的诊断标准[2]:正常嘌呤饮食状态下,非同日2次空腹SUA水平:男性>420 μmol/L,女性>420 μmol/L。
1.3 统计学方法 应用SPSS 25.0软件分析数据。计量资料采用独立样本t检验;非正态分布计量资料采用Mann-Whitney U检验;计数资料采用χ2检验;采用多因素Logistic回归分析T2DM患者发生HUA的影响因素。P<0.05为差异有统计学意义。
2 结 果
2.1 T2DM患者中HUA的发生率 T2DM患者中HUA的发生率为18.8% (171/912)。
2.2 2组一般资料及生化指标比较 与NUA组比较,HUA组TC水平升高,且男性、HUA家族史、使用格列喹酮的比例升高,使用达格列净的比例降低,差异均有统计学意义(P<0.05)。见表1。
表1 2组一般临床资料的比较
Table 1 Comparison of general clinical data between two groups
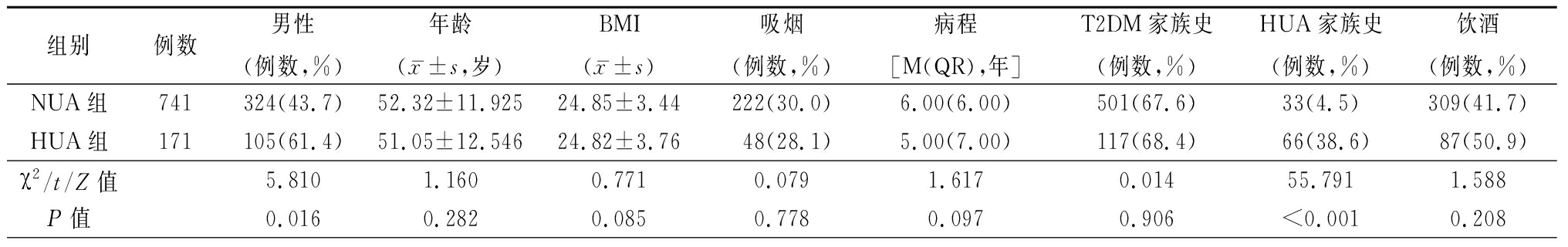
组别例数男性(例数,%)年龄(x-±s,岁)BMI(x-±s)吸烟(例数,%)病程[M(QR),年]T2DM家族史(例数,%)HUA家族史(例数,%)饮酒(例数,%)NUA组741324(43.7)52.32±11.92524.85±3.44222(30.0)6.00(6.00)501(67.6)33(4.5)309(41.7)HUA组171105(61.4)51.05±12.54624.82±3.7648(28.1)5.00(7.00)117(68.4)66(38.6)87(50.9)χ2/t/Z值5.8101.1600.7710.0791.6170.01455.7911.588P值0.0160.2820.0850.7780.0970.906<0.0010.208
表1 (续)
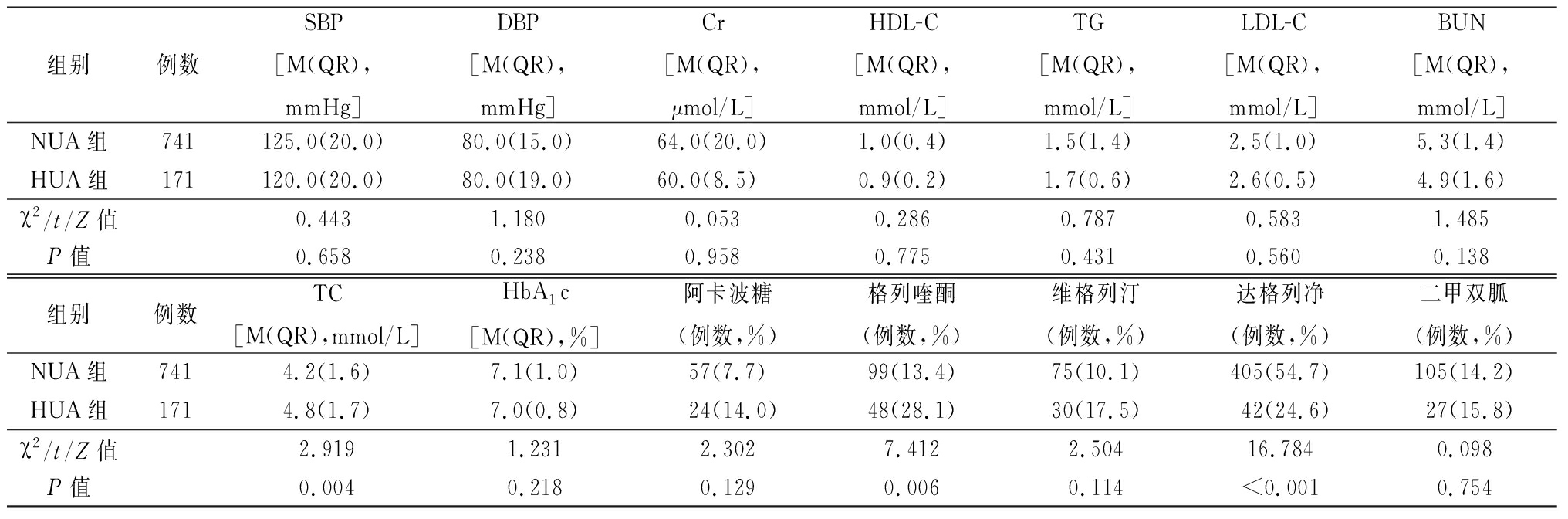
组别例数SBP[M(QR),mmHg]DBP[M(QR),mmHg]Cr[M(QR),μmol/L]HDL-C[M(QR),mmol/L]TG[M(QR),mmol/L]LDL-C[M(QR),mmol/L]BUN[M(QR),mmol/L]NUA组741125.0(20.0)80.0(15.0)64.0(20.0)1.0(0.4)1.5(1.4)2.5(1.0)5.3(1.4)HUA组171120.0(20.0)80.0(19.0)60.0(8.5) 0.9(0.2)1.7(0.6)2.6(0.5)4.9(1.6)χ2/t/Z值0.4431.1800.0530.2860.7870.5831.485P值0.6580.2380.9580.7750.4310.5600.138组别例数TC[M(QR),mmol/L]HbA1c[M(QR),%]阿卡波糖(例数,%)格列喹酮(例数,%)维格列汀(例数,%)达格列净(例数,%)二甲双胍(例数,%)NUA组7414.2(1.6)7.1(1.0)57(7.7)99(13.4)75(10.1)405(54.7)105(14.2)HUA组1714.8(1.7)7.0(0.8)24(14.0)48(28.1)30(17.5)42(24.6)27(15.8)χ2/t/Z值2.9191.2312.3027.4122.50416.7840.098P值0.0040.2180.1290.0060.114<0.0010.754
1 mmHg=0.133 kPa
2.3 T2DM患者HUA与各指标的相关性分析 男性、HUA家族史、TC、HbA1c、使用达格列净、格列喹酮等指标与T2DM患者HUA有相关性,见表2。
表2 HUA与各指标的相关性分析
Table 2 Correlation analysis between HUA
and various indicators
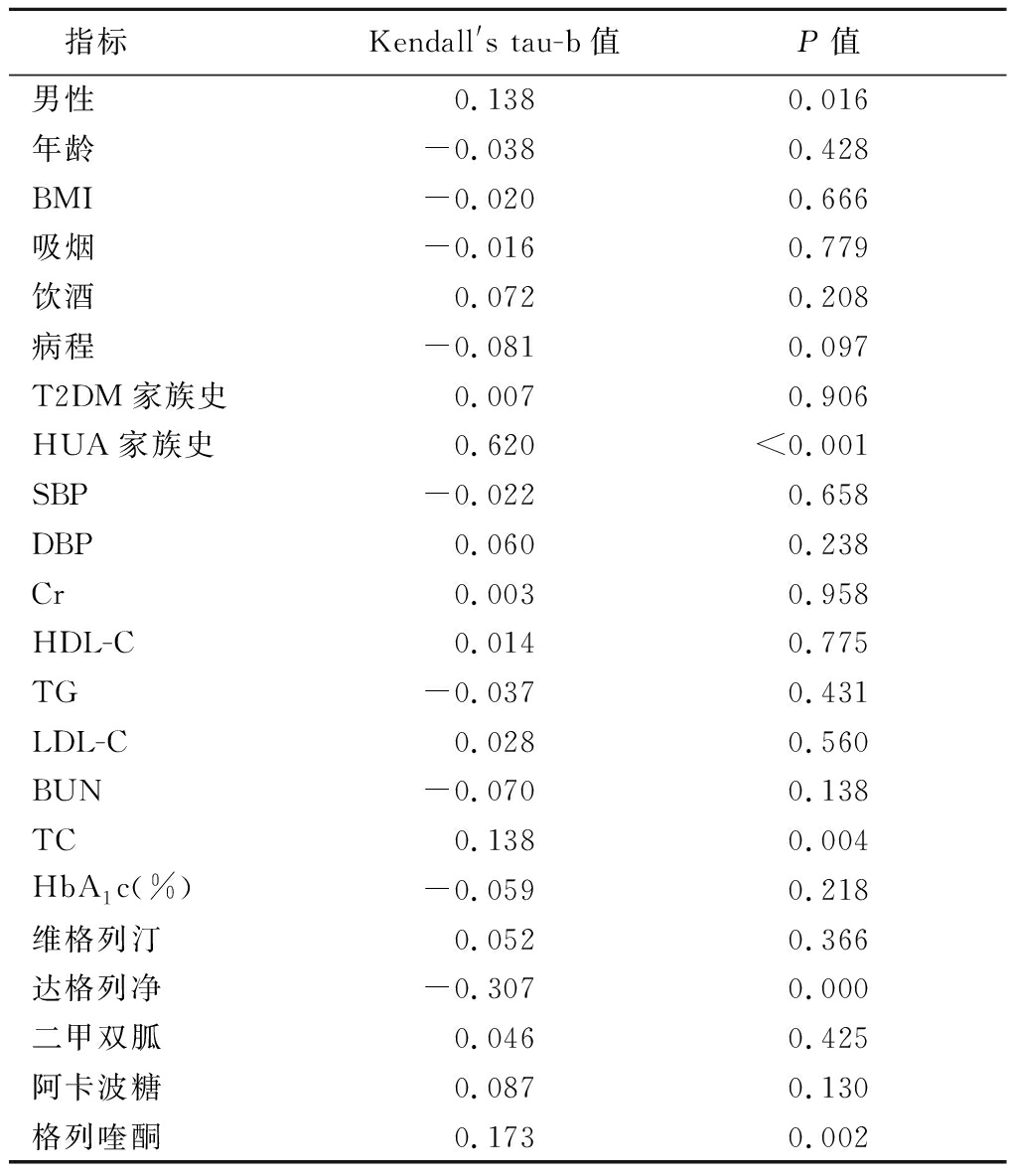
指标Kendall's tau-b值P值男性0.1380.016年龄-0.0380.428BMI-0.0200.666吸烟-0.0160.779饮酒0.0720.208病程-0.0810.097T2DM家族史0.0070.906HUA家族史0.620<0.001SBP-0.0220.658DBP0.0600.238Cr0.0030.958HDL-C0.0140.775TG-0.0370.431LDL-C0.0280.560BUN-0.0700.138TC0.1380.004HbA1c(%)-0.0590.218维格列汀0.0520.366达格列净-0.3070.000二甲双胍0.0460.425阿卡波糖0.0870.130格列喹酮0.1730.002
2.4 Logistic回归分析T2DM患者发生HUA的影响因素 以是否发生HUA(是=1,否=0)为因变量,以年龄(连续型变量)、BMI(连续型变量)、病程(连续型变量)、男性(是=1,否=0)、吸烟(是=1,否=0)、饮酒(是=1,否=0)、T2DM家族史(是=1,否=0)、HUA家族史(是=1,否=0)、HbA1c(连续型变量)、TC(连续型变量)、TG(连续型变量)、LDL-C(连续型变量)、SBP(连续型变量)、DBP(连续型变量)、使用达格列净(是=1,否=0)、二甲双胍(是=1,否=0)、阿卡波糖(是=1,否=0)、格列喹酮(是=1,否=0)、维格列汀(是=1,否=0)等因素为自变量,行多因素Logistic回归分析,结果显示,校正混杂因素后,使用达格列净(OR=0.414,95%CI:0.205~0.848,P<0.05)是T2DM患者HUA的保护因素,男性(OR=2.033,95%CI:1.054~3.921,P<0.05)、HUA家族史(OR=9.631,95%CI:4.1131~22.452,P<0.001)是T2DM患者HUA的危险因素。见表3。
表3 T2DM患者发生HUA危险因素的Logistic回归分析
Table 3 Logistic regression analysis of the imfluencing factors of HUA in T2DM patients

变量回归系数标准误Wald χ2值P值OR值95%CI达格列净-0.8760.3635.8240.0160.4170.205~0.848男性0.7090.3354.4780.0342.0331.054~3.921HUA家族史2.2650.43227.507<0.0019.6314.131~22.452
3 讨 论
3.1 HUA患病率 随着我国人民生活水平的提高和国民经济的发展,HUA的发病率越来越高,成为又一常见的慢性代谢性疾病。近期的研究显示,在中国大陆地区HUA的总体患病率为13.3%[5],新诊断的T2DM患者HUA发生率为14.96%[6]。在本文中,单种口服降糖药物治疗的T2DM患者中,HUA发生率为18.8%。提示了在T2DM人群中, HUA发生率更高,应当受到高度关注。
3.2 T2DM与HUA紧密联系的原因 近年来的研究发现,SUA升高是心脑血管病、糖尿病等疾病的独立危险因素[7];HUA和T2DM均与胰岛素抵抗相关,较高的SUA水平可能先于胰岛素抵抗发生[8]。高胰岛素血症可通过增加黄嘌呤氧化酶的合成速率而导致HUA,黄嘌呤氧化酶是一种参与SUA生成的酶[9]。HUA与T2DM互相影响,互为因果,导致疾病的进一步恶化。
一项针对3 207例T2DM患者的研究发现[10],HUA组DM大血管病变的患病率显著高于正常组,尿酸与DM大血管病变具有相关性,尤其是在女性患者中更明显。一项对500例初诊T2DM的回顾性分析研究结果提示,SUA与尿微量蛋白呈正相关,提示HUA是 T2DM 患者出现尿蛋白的危险因素[11]。体外实验表明高浓度UA通过激活炎症反应和诱导氧化应激导致内皮功能障碍,增加了肾损伤的风险[12]。亦有不同的研究结果显示,在180名T2DM患者中,SUA与视网膜神经纤维层和黄斑厚度相关性均较差[13]。一项Meta分析显示伴有周围神经病变的T2DM患者SUA水平明显升高,HUA与周围神经病变风险增加有关[14]。
3.3 发生HUA的危险因素分析
3.3.1 口服降糖药物 T2DM患者的HUA通常是由于高胰岛素血症引起的UA盐排泄不足所致[15]。口服糖尿病药物对降低SUA水平可能有额外的效益。
钠-葡萄糖共转运蛋白2(sodium-glucose cotransporter-2,SGLT2)抑制剂[16],其主要药理作用为通过减少肾小管对葡萄糖的重吸收来增加肾脏葡萄糖的排出。现有的研究发现,SGLT2抑制剂除降糖作用外,还有降低SUA,降低心血管病死率、体重及改善血压等作用[17]。2019年的一项Meta分析结果显示,卡格列净、达格列净、恩格列净分别降低尿酸37.02、38.00、42.07 μmol/L[18]。SGLT2抑制剂降低SUA的机制[19,20],可能与SGLT2抑制剂能改善胰岛素的敏感性及胰岛β细胞功能,可使内源性胰岛素含量相对减少,使肾小管表面UA转运体的表达发生改变,进而导致UA重吸收降低、排泄增加。
多项研究结果显示,二甲双胍可提高T2DM患者外周组织对胰岛素的敏感性,从而降低循环胰岛素水平,从而降低高胰岛素血症减少UA排泄的影响[21];格列本脲对T2DM患者的SUA水平没有显著影响[4];阿卡波糖似乎通过抑制蔗糖吸收来减弱蔗糖摄入引起的SUA升高[22];利格列汀在体外直接抑制黄嘌呤氧化酶活性,降低T2DM患者的SUA水平[23-24]。
本研究结果显示,使用达格列净单药降糖的患者比率在NUA组为54.7%,在HUA组为24.6%,2组差异有统计学意义(P<0.001);使用格列喹酮单药降糖的患者比率在NUA组为13.4%,在HUA组为28.1%,2组之间的差异有统计学意义(P=0.006);而使用维格列汀、二甲双胍、阿卡波糖等单药降糖治疗的患者比率在2组之间的差异无统计学意义。Logistic回归分析结果显示,使用达格列净是T2DM患者HUA的保护因素(OR=0.414,95%CI:0.205~0.848)。
3.3.2 性别 T2DM人群中HUA发生率存在性别差异。本研究结果显示,在NUA组,男性患者比率为43.7%;在HUA组,男性患者比率为61.4%;2组之间的差异有统计学意义(P=0.016);Logistic回归分析结果显示,男性是T2DM患者HUA的危险因素(OR=2.033,95%CI:1.054~3.921)。在普通人群发生率中性别差异亦存在[5],男性和女性的患病率分别为19.4%和7.9%,推测其发生机制与性激素有关。尽管性激素对SUA代谢的直接影响尚不清楚,但已有研究表明性激素可能在SUA代谢中发挥作用。一项回顾性队列研究显示,绝经后妇女SUA升高,但激素治疗后降低;进一步分析显示,与非激素治疗组比较,雌激素加孕激素治疗组的SUA水平显著降低,雌激素治疗组及替勃龙治疗组的SUA变化差异无统计学意义,提示孕激素可降低SUA水平[25]。另有对40~64岁的日本健康男性激素变化的前瞻性研究显示[26],年龄与游离睾酮呈负相关,但与总睾酮无关,校正年龄后,线性回归分析显示总睾酮与SUA呈负相关。
3.3.3 HUA家族史 HUA亲属SUA水平可受饮食、体重、生活方式改变等环境因素的影响;对儿童发病患者,应经常考虑影响ABCG2功能的遗传因素,ABCG2基因分型对早期和(或)家族史患者痛风/HUA的风险评估至关重要[27]。研究发现,台湾儿童痛风性关节炎阳性家族史与HUA相关[28]。亦有不同的研究结果,对北京市社区老年人(50岁以上人群)痛风与HUA的现代流行病学研究中,观察到家族史是痛风而不是HUA的危险因素[29]。本文Logistic回归分析结果显示,HUA家族史是T2DM患者HUA的危险因素(OR=9.631,95%CI:4.1131~22.452)。
3.3.4 脂代谢 对成年体检受试者的研究发现,临床上无症状的HUA患者的TC、TG水平明显高于SUA正常者[30];HUA与LDL 升高之间具有高度的关联性[31]。HUA可能是高LDL和高TG血症发生发展潜在的危险因素,这可能与 SUA在脂肪生成和阻断脂肪酸氧化中发挥重要作用有关[31]。
一项回顾性分析研究显示[32],在青年(20~45岁)T2DM合并HUA人群中,SUA水平与血脂异常也有一定的关系,与SUA正常组相比,HUA组TG水平升高;进一步Logistic回归分析显示高血压、代谢综合征和睡眠质量差为这类患者并发HUA的危险因素。
本研究结果显示,与NUA组比较,HUA组TC水平升高(P<0.05或P<0.001)。
3.3.5 其他 在本研究中,少量饮酒和吸烟并没有增加HUA的发病风险,可能是与我们的受试者饮酒较少有关。本研究亦没有考虑进食海鲜、含糖饮料等高嘌呤食物对SUA的影响,因本研究患者为单药降糖治疗的T2DM患者,2组患者血糖控制均较理想(NUA组HbA1c中位数为7.1%,HUA组HbA1c中位数为7.0%),提示患者日常饮食控制较合理。另外,由于本研究属于横断面研究,无法得知降糖药物的使用时间,且未考虑药物使用剂量。
综上所述,在单药降糖治疗的T2DM患者中,合并HUA者可能占到1/5;而使用达格列净是T2DM患者发生HUA的保护因素,男性、HUA家族史是T2DM患者发生HUA的危险因素;提示在日常临床工作中,对于T2DM患者不仅要予以患者生活方式干预的指导,同时还应密切关注降糖药物的选择。
[1] 张晓洁,姜林娣.尿酸代谢异常与慢性炎症的新认识[J].中华医学杂志,2018,98(13):963-964.
[2] 高尿酸血症相关疾病诊疗多学科共识专家组.中国高尿酸血症相关疾病诊疗多学科专家共识[J].中华内科杂志,2017,56(3):235-248.
[3] 蔡晓凌,陈祎霏,韩斐斐,等.高尿酸血症与2型糖尿病[J].中国心血管杂志,2016,21(1):8-10.
[4] Hussain A,Latiwesh OB,Ali F,et al. Effects of body mass index,glycemic control,and hypoglycemic drugs on serum uric acid levels in type 2 diabetic patients[J]. Cureus,2018,10(8):e3158.
[5] Liu R,Han C,Wu D,et al. Prevalence of hyperuricemia and gout in mainland China from 2000 to 2014: asystematic review and Meta-analysis[J]. Biomed Res Int,2015,2015:762820.
[6] 倪娟,刘康,邬步云,等.新诊断2型糖尿病患者合并高尿酸血症的危险因素分析[J].南京医科大学学报(自然科学版),2018,38(11):1540-1544.
[7] Wang H,Wei Y,Kong X,et al. Effects of urate-lowering therapy in hyperuricemia on slowing the progression of renal function: a meta-analysis[J]. J Ren Nutr,2013,23(5):389-396.
[8] Han T,Lan L,Qu R,et al. Temporal relationship between hyperuricemia and insulin resistance and its impact on future risk of hypertension[J]. Hypertension,2017,70(4):703-711.
[9] Cameron MA,Maalouf NM,Adams-Huet B,et al. Urine composition in type 2 diabetes: predisposition to uric acid nephrolithiasis[J]. J Am Soc Nephrol,2006,17(5):1422-1428.
[10] Yan D,Wang J,Jiang F,et al. A causal relationship between uric acid and diabetic macrovascular disease in Chinese type 2 diabetes patients:a mendelian randomization analysis[J]. Int J Cardiol,2016,214:194-199.
[11] 李华青,周苗,王娟,等.尿酸水平与初诊2型糖尿病的相关性研究[J].中国药物与临床,2020,20(7):1169-1170.
[12] Li Y,Fan X,Li C,et al. The relationships among hyperuricemia,body mass index and impaired renal function in type 2 diabetic patients[J]. Endocr J,2018,65(3):281-290.
[13] Vinuthinee-Naidu MN,Zunaina E,Azreen-Redzal A,et al. Correlation of retinal nerve fibre layer and macular thickness with serum uric acid among type 2 diabetes mellitus[J]. BMC Ophthalmol,2017,17(1):91.
[14] Yu S,Chen Y,Hou X,et al. Serum uric acid levels and diabetic peripheral neuropathy in type 2 diabetes: a systematic review and Meta-analysis[J]. Mol Neurobiol,2016,53(2):1045-1051.
[15] Tsunoda S,Kamide K,Minami J,et al. Decreases in serum uric acid by amelioration of insulin resistance in overweight hypertensive patients:effect of a low-energy diet and an insulin-sensitizing agent[J]. Am J Hypertens,2002,15(8):697-701.
[16] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2017年版)[J].中华糖尿病杂志,2018,10(1):4-67.
[17] Kramer CK,Zinman B. Sodium-glucose cotransporter-2(SGLT-2) inhibitors and the treatment of type 2 diabetes[J]. Annu Rev Med,2019,70:323-334.
[18] Xin Y,Guo Y,Li Y,et al. Effects of sodium glucose cotransporter-2 inhibitors on serum uric acid in type 2 diabetes mellitus:a systematic review with an indirect comparison Meta-analysis[J]. Saudi J Biol Sci,2019,26(2):421-426.
[19] 卢韵弘,陈莉明.SGLT2抑制剂与高尿酸血症[J].中国实用内科杂志,2020,40(8):625-629.
[20] Ahmadieh H,Azar S. Effects of sodium glucose cotransporter-2 inhibitors on serum uric acid in type 2 diabetes mellitus[J]. Diabetes Technol Ther,2017,19(9):507-512.
[21] Bailey CJ,Turner RC. Metformin[J]. N Engl J Med,1996,334(9):574-579.
[22] Moriwaki Y,Inokuchi T,Ka T,et al. Effect of acarbose on the increased plasma concentration of uric acid induced by sucrose ingestion[J]. Nucleosides Nucleotides Nucleic Acids,2008,27(6):631-633.
[23] Shimodaira M,Niwa T,Nakajima K,et al. Beneficial effects of Vildagliptin on metabolic parameters in patients with type 2 diabetes[J]. Endocr Metab Immune Disord Drug Targets,2015,15(3):223-228.
[24] Yamagishi S,Ishibashi Y,Ojima A,et al. Linagliptin,a xanthine-based dipeptidyl peptidase-4 inhibitor,decreases serum uric acid levels in type 2 diabetic patients partly by suppressing xanthine oxidase activity[J]. Int J Cardiol,2014,176(2):550-552.
[25] Jung JH,Song GG,Lee YH,et al. Serum uric acid levels and hormone therapy type: a retrospective cohort study of postmenopausal women[J]. Menopause,2018,25(1):777-781.
[26] Fukai S,Akishita M,Miyao M,et al. Age-related changes in plasma androgen levels and their association with cardiovascular risk factors in male Japanese office workers[J]. Geriatr Gerontol Int,2010,10(1):32-39.
[27] Stiburkova B,Pavelcova K,Pavlikova M,et al. The impact of dysfunctional variants of ABCG2 on hyperuricemia and gout in pediatric-onset patients[J]. Arthritis Res Ther,2019,21(1):77.
[28] Liu CS,Li TC,Lin CC. The epidemiology of hyperuricemia in children of Taiwan aborigines[J]. J Rheumatol,2003,30(4):841-845.
[29] Lu X,Li X,Zhao Y,et al. Contemporary epidemiology of gout and hyperuricemia in community elderly in Beijing[J]. Int J Rheum Dis,2014,17(4):400-407.
[30] 潘英姿,沈月平,周义红,等.血尿酸与血脂代谢相关指标的相关性研究[J].实用心脑肺血管病杂志,2012,20(5):797-799.
[31] 郭珺,罗文浩,鲜文.高血尿酸水平与高脂血症的相关性研究[J].现代医学,2019,47(7):801-804.
[32] 黄花,徐冬冬,任建宇.2型糖尿病合并高尿酸血症青年患者代谢相关因素分析[J].中国现代医学杂志,2020,30(21):53-57.