2型糖尿病(type 2 diabetes mellitus,T2DM)患者肥胖/超重率较高,肥胖/超重可影响机体血脂代谢,降低胰岛素敏感性,并与高尿酸血症、心脑血管疾病的风险相关,严重危害患者生命健康,因此有效控制血糖,改善肥胖/超重意义重大[1-3]。目前已证实肠道菌群失调可影响葡萄糖利用度,导致能量代谢异常、胰岛素抵抗、血脂紊乱、脂肪合成和堆积等,与肥胖/超重、T2DM发生显著相关[4-6]。二甲双胍是治疗T2DM基础药物,其降糖作用已被大量报道所证实,但单纯依赖二甲双胍对肥胖/超重改善有限[7-8]。达格列净系钠-葡萄糖转运蛋白2抑制剂,可降低血糖[9]。但与二甲双胍联合是否能增强改善肥胖/超重效果尚不明确,且现阶段关于达格列净联合二甲双胍对机体肠道微生态影响的报道鲜见。本研究选取112例肥胖/超重型T2DM患者,从肠道微生态等角度探讨达格列净联合二甲双胍的应用价值,为临床实际防治肥胖/超重型T2DM及其相关危害提供客观参考。
1 资料与方法
1.1 一般资料 选取2017年2月—2019年10月肥胖/超重型T2DM患者112例为研究对象,采用电脑随机数字表法按1∶1原则分为2组,各56例。两组一般资料比较差异无统计学意义(P>0.05),见表1。
表1 两组一般资料比较
Table 1 Comparison of baseline data between two groups
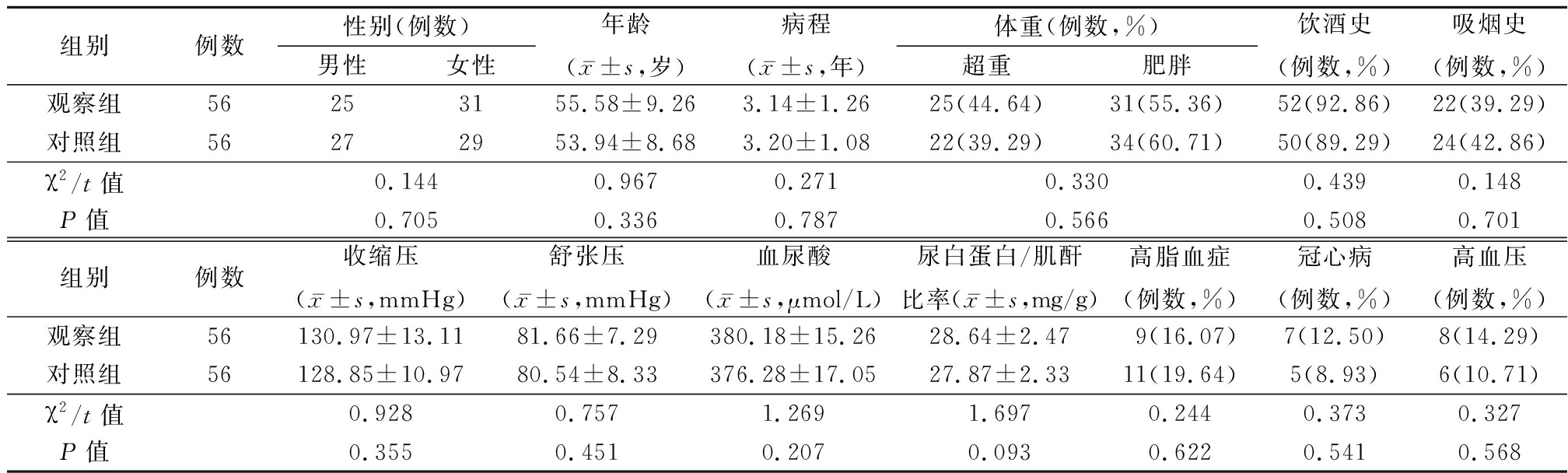
组别例数性别(例数)男性女性年龄(x-±s,岁)病程(x-±s,年)体重(例数,%)超重肥胖饮酒史(例数,%)吸烟史(例数,%)观察组56253155.58±9.263.14±1.2625(44.64)31(55.36)52(92.86)22(39.29)对照组56272953.94±8.683.20±1.0822(39.29)34(60.71)50(89.29)24(42.86)χ2/t值0.1440.9670.2710.3300.4390.148P值0.7050.3360.7870.5660.5080.701组别例数收缩压(x-±s,mmHg)舒张压(x-±s,mmHg)血尿酸(x-±s,μmol/L)尿白蛋白/肌酐比率(x-±s,mg/g)高脂血症(例数,%)冠心病(例数,%)高血压(例数,%)观察组56130.97±13.1181.66±7.29380.18±15.2628.64±2.479(16.07)7(12.50)8(14.29)对照组56128.85±10.9780.54±8.33376.28±17.0527.87±2.3311(19.64)5(8.93)6(10.71)χ2/t值0.9280.7571.2691.6970.2440.3730.327P值0.3550.4510.2070.0930.6220.5410.568
超重:BMI 24.00~28.00(不含28);肥胖:BMI≥28.00 1 mmHg=0.133 kPa
本研究获医院伦理委员会审核通过,患者充分知情,自愿签署知情同意书。
1.2 纳入标准与排除标准 纳入标准:符合T2DM诊断标准[10];体重指数(body mass index,BMI)≥24.00;入组前2周无相关治疗史。排除标准:糖尿病酮症酸中毒者;糖尿病足者;心脑肝肾功能严重不全者;急性心肌梗死者;严重感染者;过敏体质者;癌症患者;脑梗死者。
1.3 方法
1.3.1 常规干预 两组均给予饮食指导、运动指导、健康宣教。
1.3.2 对照组 给予二甲双胍(悦康药业集团股份有限公司,国药准字H20051289)治疗,每次0.5~1 g,根据患者血糖情况1~2次/d,口服,早和(或)晚餐时服用。
1.3.3 观察组 给予达格列净联合二甲双胍(方法同对照组)治疗。达格列净(AstraZeneca AB,批准文号H20170117)10 mg/次,1次/d,早晨服用。两组均治疗6个月。
1.3.4 各指标检测 于治疗前、治疗3个月、6个月后分别采集肘部静脉血,采用血糖仪(国强生公司稳豪型)检测空腹血糖(fasting plasma glucose,FPG)、餐后2 h血糖(postprandial two-hour plasma glucose,2 hPG)水平(标准餐后),采用高压液相色谱法检测糖化血红蛋白(Hemoglobin A1c,HbA1c)水平,稳态模型胰岛素抵抗指数(homeostasis model assessment,HOMA-IR)=FPG(mmol/L)×空腹胰岛素水平(mU/L)/22.5;采用全自动生化分析仪(日本Hitachi公司7600型)检测高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、三酰甘油(triglycerides,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平;采用酶联免疫吸附法检测血清能量平衡相关蛋白(adropin)、趋化素(chemerin)、鸢尾素(irisin)水平,试剂盒购于武汉华美生物工程有限公司。
1.4 观察指标 ①比较两组治疗前、治疗3个月、6个月后血糖水平(FPG、2 hPG、HbA1c)、HOMA-IR。②比较两组治疗前、治疗3个月、6个月后腰围、BMI,腰围测量时取站立位,放松状态,软尺绕肚脐一周,BMI=体重(kg)/身高(m2)。③比较两组治疗前、治疗3个月、6个月后血脂指标:TG、TC、HDL-C、LDL-C水平。④比较两组治疗前、治疗3个月、6个月后肠道微生态:肠球菌、肠杆菌、拟杆菌、乳酸杆菌数量,采用光冈法检测新鲜粪便中各菌落数量。⑤比较两组治疗前、治疗3个月、6个月后血清adropin、chemerin、irisin水平。⑥观察用药安全性。
1.5 统计学方法 应用SPSS22.0统计软件分析数据。计量资料比较采用独立样本的t检验和重复测量方差分析,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 血糖水平、胰岛功能比较 疗程中对照组失访3例,观察组失访1例。两组治疗后3个月、6个月FPG、2 hPG、HbA1c、HOMA-IR均低于治疗前,且观察组低于对照组,组间、时点间、组间·时点间交互作用差异有统计学意义(P<0.05)。见表2。
表2 两组血糖水平、胰岛功能比较
Table 2 Comparison of blood glucose levels and islet function between two groups![]()
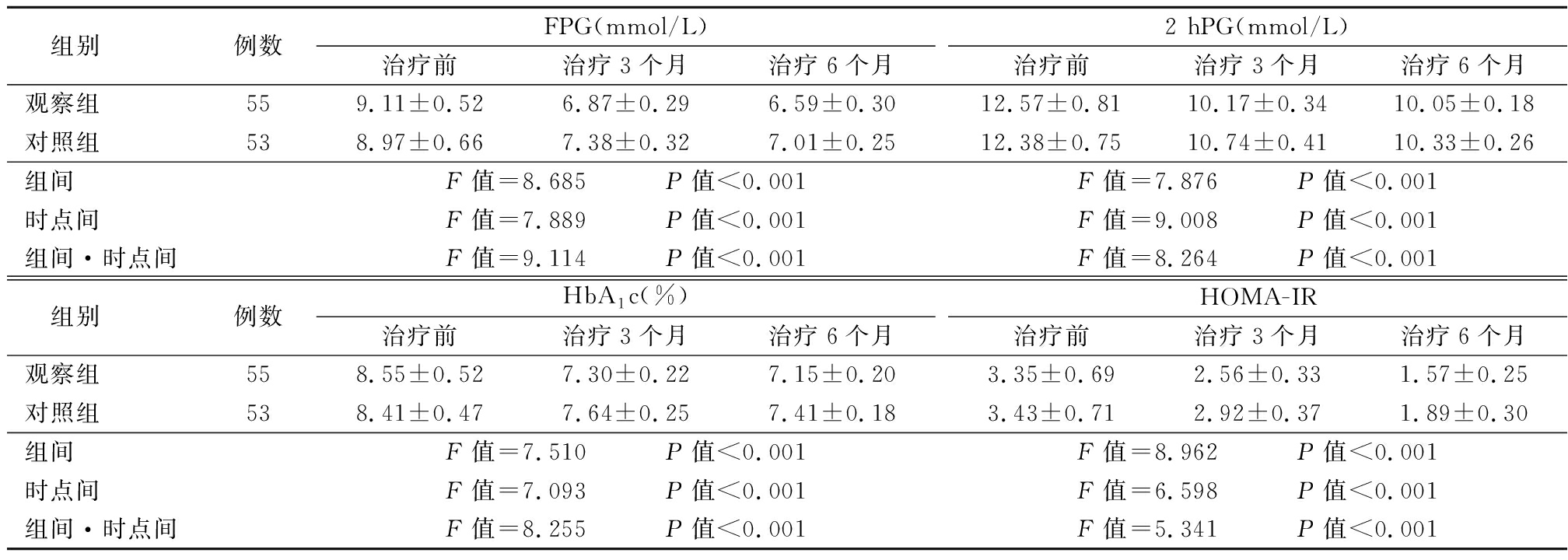
组别例数FPG(mmol/L)治疗前治疗3个月治疗6个月2 hPG(mmol/L)治疗前治疗3个月治疗6个月观察组559.11±0.526.87±0.296.59±0.3012.57±0.8110.17±0.3410.05±0.18对照组538.97±0.667.38±0.327.01±0.2512.38±0.7510.74±0.4110.33±0.26组间F值=8.685 P值<0.001F值=7.876 P值<0.001时点间F值=7.889 P值<0.001F值=9.008 P值<0.001组间·时点间F值=9.114 P值<0.001F值=8.264 P值<0.001 组别例数HbA1c(%)治疗前治疗3个月治疗6个月HOMA-IR治疗前治疗3个月治疗6个月观察组558.55±0.527.30±0.227.15±0.203.35±0.692.56±0.331.57±0.25对照组538.41±0.477.64±0.257.41±0.183.43±0.712.92±0.371.89±0.30组间F值=7.510 P值<0.001F值=8.962 P值<0.001时点间F值=7.093 P值<0.001F值=6.598 P值<0.001组间·时点间F值=8.255 P值<0.001F值=5.341 P值<0.001
2.2 两组腰围、BMI比较 与治疗前相比,两组治疗6个月腰围均降低;观察组治疗6个月BMI低于治疗前;观察组治疗6个月腰围、BMI低于对照组,组间、时点间、组间·时点间交互作用差异有统计学意义(P<0.05)。见表3。
表3 两组腰围、BMI比较
Table 3 Comparison of waist circumference and BMI between two groups![]()
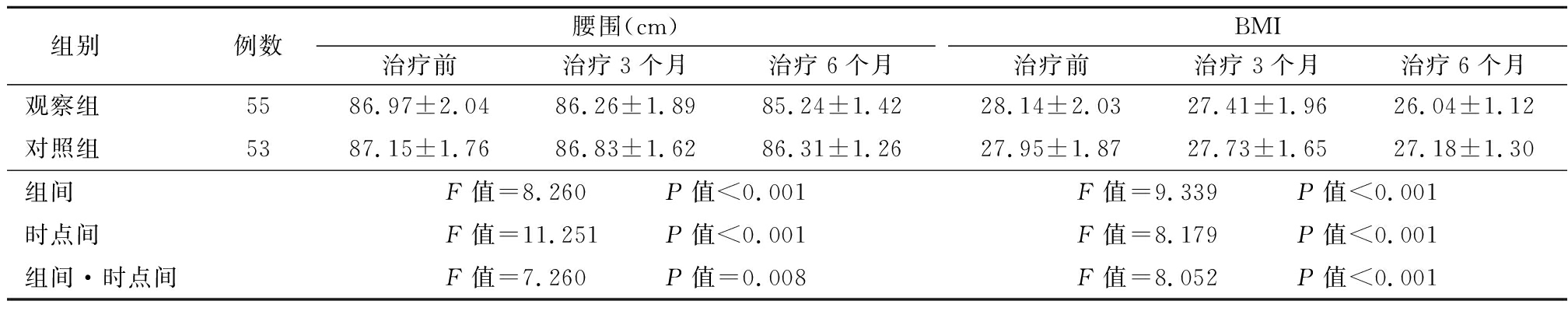
组别例数腰围(cm)治疗前治疗3个月治疗6个月BMI治疗前治疗3个月治疗6个月观察组5586.97±2.0486.26±1.8985.24±1.4228.14±2.0327.41±1.9626.04±1.12对照组5387.15±1.7686.83±1.6286.31±1.2627.95±1.8727.73±1.6527.18±1.30组间F值=8.260 P值<0.001F值=9.339 P值<0.001时点间F值=11.251 P值<0.001F值=8.179 P值<0.001组间·时点间F值=7.260 P值=0.008F值=8.052 P值<0.001
2.3 两组血脂指标比较 两组治疗3、6个月后TG低于治疗前,且观察组低于对照组;与治疗前相比,两组治疗3、6个月后HDL-C均升高,且观察组高于对照组,组间、时点间、组间·时点间交互作用差异有统计学意义(P<0.05)。见表4。
表4 两组血脂指标比较
Table 4 Comparison of blood lipid indexes between two groups![]()
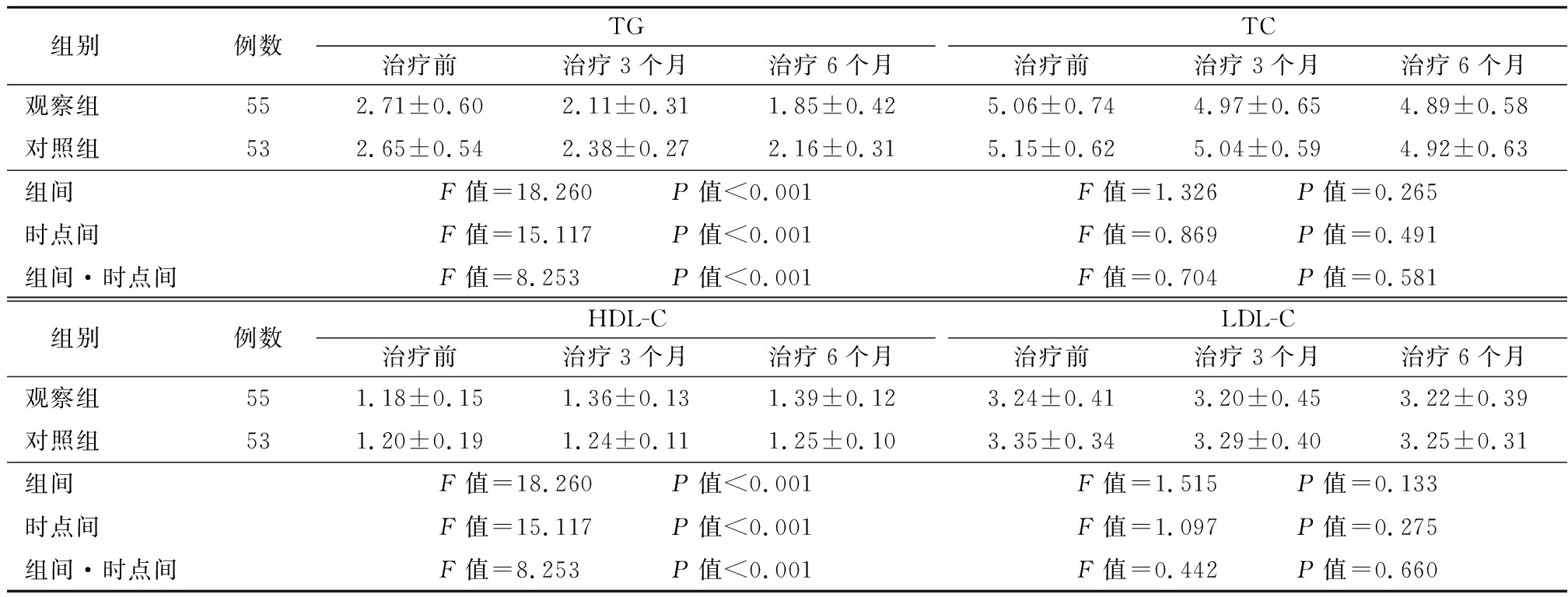
组别例数TG治疗前治疗3个月治疗6个月TC治疗前治疗3个月治疗6个月观察组552.71±0.602.11±0.311.85±0.425.06±0.744.97±0.654.89±0.58对照组532.65±0.542.38±0.272.16±0.315.15±0.625.04±0.594.92±0.63组间F值=18.260 P值<0.001F值=1.326 P值=0.265时点间F值=15.117 P值<0.001F值=0.869 P值=0.491组间·时点间F值=8.253 P值<0.001F值=0.704 P值=0.581 组别例数HDL-C治疗前治疗3个月治疗6个月LDL-C治疗前治疗3个月治疗6个月观察组551.18±0.151.36±0.131.39±0.123.24±0.413.20±0.453.22±0.39对照组531.20±0.191.24±0.111.25±0.103.35±0.343.29±0.403.25±0.31组间F值=18.260 P值<0.001F值=1.515 P值=0.133时点间F值=15.117 P值<0.001F值=1.097 P值=0.275组间·时点间F值=8.253 P值<0.001F值=0.442 P值=0.660
2.4 两组肠道微生态变化比较 两组治疗6个月后肠球菌、肠杆菌数量低于治疗前,拟杆菌、乳酸杆菌数量高于治疗前;观察组治疗6个月后肠球菌、肠杆菌数量低于对照组,拟杆菌、乳酸杆菌数量高于对照组,组间、时点间、组间·时点间交互作用差异有统计学意义(P<0.05)。见表5。
表5 两组肠道微生态变化比较
Table 5 Comparison of intestinal microecological changes between two groups ![]() 粪便)
粪便)
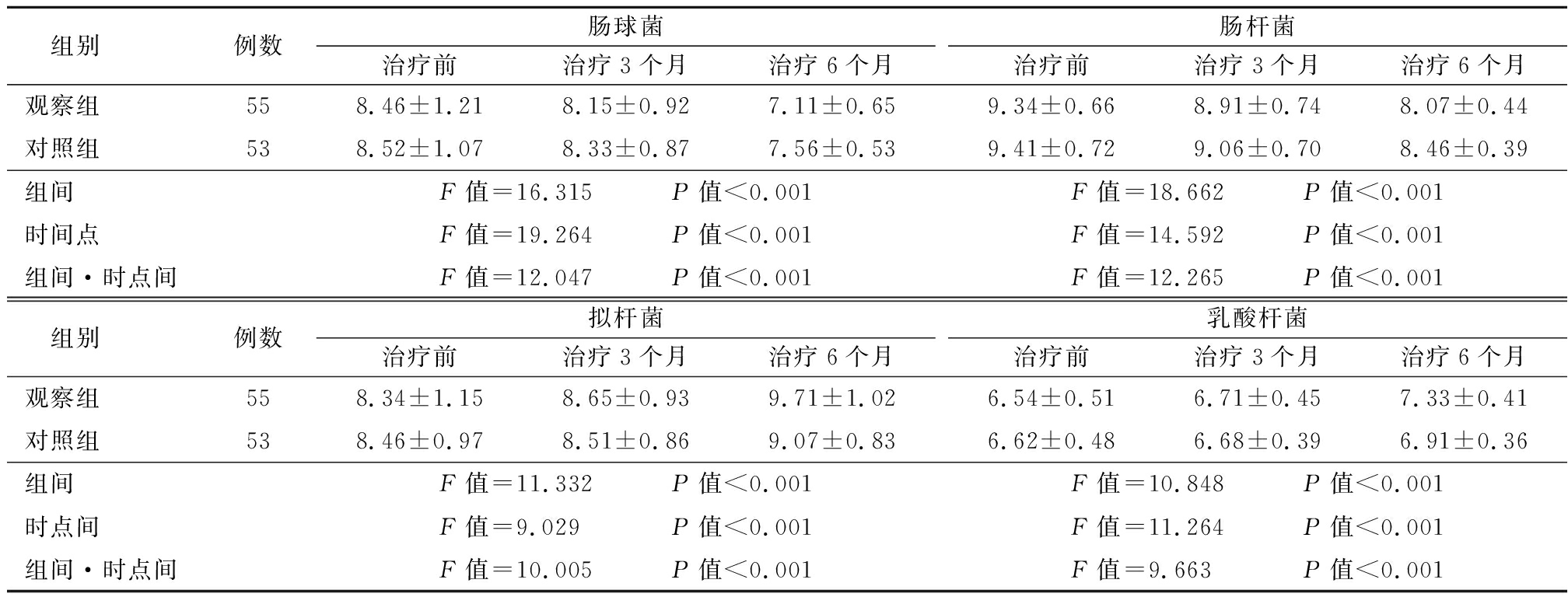
组别例数肠球菌治疗前治疗3个月治疗6个月肠杆菌治疗前治疗3个月治疗6个月观察组558.46±1.218.15±0.927.11±0.659.34±0.668.91±0.748.07±0.44对照组538.52±1.078.33±0.877.56±0.539.41±0.729.06±0.708.46±0.39组间F值=16.315 P值<0.001F值=18.662 P值<0.001时间点F值=19.264 P值<0.001F值=14.592 P值<0.001组间·时点间F值=12.047 P值<0.001F值=12.265 P值<0.001 组别例数拟杆菌治疗前治疗3个月治疗6个月乳酸杆菌治疗前治疗3个月治疗6个月观察组558.34±1.158.65±0.939.71±1.026.54±0.516.71±0.457.33±0.41对照组538.46±0.978.51±0.869.07±0.836.62±0.486.68±0.396.91±0.36组间F值=11.332 P值<0.001F值=10.848 P值<0.001时点间F值=9.029 P值<0.001F值=11.264 P值<0.001组间·时点间F值=10.005 P值<0.001F值=9.663 P值<0.001
2.5 两组adropin、chemerin、irisin比较 两组治疗3、6个月后adropin、irisin均高于治疗前,chemerin均低于治疗前;观察组治疗3、6个月后adropin、irisin高于对照组,chemerin低于对照组,组间、时点间、组间·时点间交互作用差异有统计学意义(P<0.05)。见表6。
表6 两组adropin、chemerin、irisin比较
Table 6 Comparison of adropin, chemerin and irisin between two groups![]()
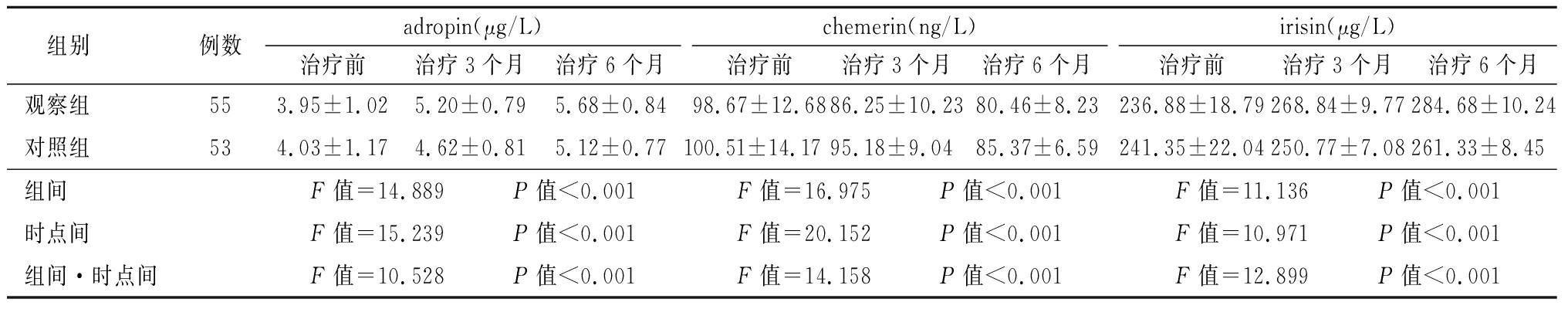
组别例数adropin(μg/L)治疗前治疗3个月治疗6个月chemerin(ng/L)治疗前治疗3个月治疗6个月irisin(μg/L)治疗前治疗3个月治疗6个月观察组553.95±1.025.20±0.795.68±0.8498.67±12.6886.25±10.2380.46±8.23236.88±18.79268.84±9.77284.68±10.24对照组534.03±1.174.62±0.815.12±0.77100.51±14.1795.18±9.0485.37±6.59241.35±22.04250.77±7.08261.33±8.45组间F值=14.889 P值<0.001F值=16.975 P值<0.001F值=11.136 P值<0.001时点间F值=15.239 P值<0.001F值=20.152 P值<0.001F值=10.971 P值<0.001组间·时点间F值=10.528 P值<0.001F值=14.158 P值<0.001F值=12.899 P值<0.001
2.6 两组不良反应比较 不良反应总发生率观察组为5.45%,对照组为9.09%,两组比较差异无统计学意义(P>0.05)。见表7。
表7 两组不良反应比较
Table 7 Comparison of adverse reactions between two groups (例数,%)
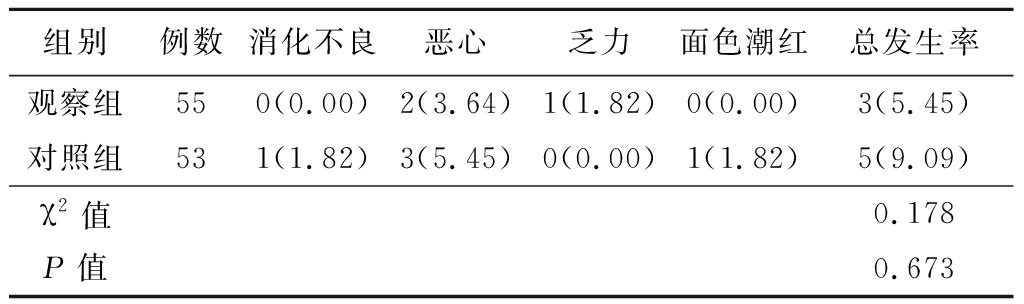
组别例数消化不良恶心乏力面色潮红总发生率观察组550(0.00)2(3.64)1(1.82)0(0.00)3(5.45)对照组531(1.82)3(5.45)0(0.00)1(1.82)5(9.09)χ2值0.178P值0.673
3 讨 论
目前T2DM的治疗仍以药物为主,治疗目标是有效控制血糖水平,改善胰岛素抵抗。本研究结果显示,经治疗观察组血糖和胰岛功能优于对照组,与宋金方等[11]报道相似,表明达格列净联合二甲双胍治疗肥胖/超重型T2DM,可有效降低血糖水平,改善胰岛素抵抗,安全性高。二甲双胍是T2DM一线口服降糖药物,主要通过抑制肝糖原异生,降低肝糖输出,并能通过抑制肠壁细胞摄取葡萄糖、提高肠道、皮肤、血细胞等非胰岛素依赖组织对葡萄糖的利用途径,起到降糖作用[12-13]。达格列净是一种新型的抗T2DM药物,通过抑制肾内的一种使葡萄糖被重新吸收到血液中的蛋白质(钠-葡萄糖转运蛋白2),将原尿中的部分葡萄糖通过尿液被排出体外,在不增加胰岛素分泌的情况下改善血糖控制[14-15]。可见达格列净联合二甲双胍具有协同效应,故能取得满意效果。
研究显示,肠道微生态失衡与肥胖、T2DM密切相关,可通过影响机体能量吸收、肠壁通透性调节脂肪合成,且还能参与胆汁酸、碳水化合物、短链脂肪酸等代谢,诱导脂肪和脂肪酸合成的关键酶,促进肝脏TG的合成,同时肠道菌群可下调肠上皮细胞产生的禁食诱导脂肪细胞因子的表达,增加脂肪组织中TG的合成,因此肠道菌群作为重要的环境因素,可能是肥胖发生的一个重要诱因;肥胖发生后,腹部脂肪等的堆积,使肝脏、肌肉等对葡萄糖利用度降低,且肥胖者机体炎症因子和非酯化脂肪酸水平的升高,可产生内质网应激、氧化应激,引起胰岛素抵抗,从而导致T2DM[16-17]。故改善肠道微生态对超重/肥胖及T2DM的改善均意义重大。曹敏等[18]报道显示,二甲双胍调控肠道菌群构成,促进T2DM病情的缓解,本研究观点与之相似。但目前关于达格列净对T2DM肠道微生态影响的报道鲜见,本研究显示,观察组治疗6个月后肠球菌、肠杆菌数量低于对照组,拟杆菌、乳酸杆菌数量高于对照组,提示达格列净联合二甲双胍可改善机体肠道微生态,这有利于改善肥胖/超重状态。本研究的结果显示,观察组治疗3、6个月后TG、腰围、BMI低于对照组,HDL-C高于对照组,直接佐证了达格列净联合二甲双胍对肥胖/超重的改善效应。达格列净联合二甲双胍可协同纠正血糖、血脂代谢紊乱,改善了机体微环境,提高了组织器官对葡萄糖利用率,避免脂肪过度合成和堆积,肠道内环境逐渐恢复正常,有利于血糖和肥胖的控制,从而形成良性循环,促进患者T2DM病情及肥胖/超重的改善。
Chemerin系脂肪细胞因子,能通过胰岛素调控葡萄糖的摄取及组织器官对胰岛素的反应性[19]。资料显示,肥胖型T2DM患者血清chemerin水平显著高于T2DM患者及正常人群,与肥胖/超重型T2DM密切相关[20]。Adropin、irisin系生物活性蛋白及多肽,可提高葡萄糖利用度,调控血脂代谢,缓解胰岛素抵抗,降低体重,成为现阶段防治代谢综合征的新研究靶点[21-22]。目前关于达格列净联合二甲双胍对adropin、chemerin、irisin影响的报道较少,本研究显示,达格列净联合二甲双胍可降低chemerin,提高adropin、irisin,这可能是两者联合发挥抗T2DM效应的一个分子水平机制,亦提示降低chemerin,提高adropin、irisin可能有助于防治肥胖/超重型T2DM,为临床药物研发、科研方向等提供参考。值得注意的是,达格列净联合二甲双胍方案的应用要求患者肾功能无明显异常(血肌酐小于132.6 μmol/L),这对治疗对象具有选择性,而合并肾功能损害肥胖/超重型T2DM患者,采用何种方案更优尚不明确,有待后续的进一步探讨。
综上所述,达格列净联合二甲双胍治疗肥胖/超重型T2DM,可有效降低血糖水平,改善胰岛素抵抗、血脂代谢及肠道微生态,缓解肥胖/超重,安全性高,降低chemerin,提高adropin、irisin可能是两者联合发挥抗T2DM效应的一个分子水平机制,并为临床防治肥胖/超重型T2DM提供了一个新潜在靶点。
[1] Carbone S,Del Buono MG,Ozemek C,et al. Obesity, risk of diabetes and role of physical activity, exercise training and cardiorespiratory fitness[J]. Prog Cardiovasc Dis,2019,62(4):327-333.
[2] 卢萍,帅平,刘玉萍,等.体检人群体重及其变化与白蛋白尿的关联性分析[J].中华肾脏病杂志,2020,36(10):758-765.
[3] Volaco A,Cavalcanti AM,Filho RP,et al. Socioeconomic status:the missing link between obesity and diabetes mellitus[J]. Curr Diabetes Rev,2018,14(4):321-326.
[4] Canfora EE,Meex RCR,Venema K,et al. Gut microbial metabolites in obesity, NAFLD and T2DM[J]. Nat Rev Endocrinol,2019,15(5):261-273.
[5] Meijnikman AS,Gerdes VE,Nieuwdorp M,et al. Evaluating causality of gut microbiota in obesity and diabetes in humans[J]. Endocr Rev,2018,39(2):133-153.
[6] Salgaco MK,Oliveira LGS,Costa GN,et al. Relationship between gut microbiota, probiotics, and type 2 diabetes mellitus[J]. Appl Microbiol Biotechnol,2019,103(23/24):9229-9238.
[7] 赵文涛,曹高峰,焦小红,等.葛根素联合二甲双胍治疗NAFLD合并2型糖尿病前期患者初步临床研究[J].实用肝脏病杂志,2018,21(3):409-412.
[8] 纪立农,冯波,曲伸,等.二甲双胍缓释片和速释片治疗中国南北方2型糖尿病患者的疗效与安全性比较[J].中国糖尿病杂志,2019,27(5):369-374.
[9] 高芳芳,张萍,钟兴,等.达格列净对血糖控制不佳的2型糖尿病患者血糖波动的影响[J].山东医药,2020,60(14):48-50.
[10] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013年版)[J].中国糖尿病杂志,2014,30(8):893-942.
[11] 宋金方,张亮,林维娜,等.达格列净或西格列汀联合二甲双胍治疗2型糖尿病的疗效对比研究[J].实用药物与临床,2019,22(3):253-255.
[12] 谈晓娅,童强.格列美脲联合二甲双胍对初诊2型糖尿病患者糖脂代谢、胰岛功能及血清miR-126表达的影响[J].中国药房,2018,29(4):505-508.
[13] 蔡凤,刘钜荣,范德美,等.二甲双胍对2型糖尿病大鼠非酒精性脂肪性肝病相关慢性炎症反应的影响[J].实用医学杂志,2018,34(12):1965-1969.
[14] 郭彩红,高秀莹.达格列净对2型糖尿病伴代谢综合征患者代谢指标影响[J].临床军医杂志,2018,46(5):585-587.
[15] 蒋建家,张雅萍,牟伦盼,等.达格列净对预混胰岛素治疗血糖控制不达标的2型糖尿病患者的疗效和安全性研究[J].中国糖尿病杂志,2018,26(12):31-35.
[16] Kim YA,Keogh JB,Clifton PM. Probiotics, prebiotics, synbiotics and insulin sensitivity[J]. Nutr Res Rev,2018,31(1):35-51.
[17] Amin MN,Hussain MS,Sarwar MS,et al. How the association between obesity and inflammation may lead to insulin resistance and cancer[J]. Diabetes Metab Syndr,2019,13(2):1213-1224.
[18] 曹敏,薛俊,董荞菁,等.黄芩汤联合二甲双胍治疗2型糖尿病疗效及对肠道菌群构成,胰岛素信号转导分子水平影响[J].中华中医药学刊,2019,37(11):234-237.
[19] 宋秋萍,胡淼.GLP-1类似物联合阿卡波糖对肥胖2型糖尿病患者血清Chemerin、Visfatin、HbA1c水平的影响[J].中国医师杂志,2018,20(12):1858.
[20] 黄文森,孙志纯,洪真真,等.2型糖尿病患者血清chemerin,non-HDL-C/HDL-C与微量白蛋白尿的相关性[J].南京医科大学学报(自然科学版),2018,38(9):1259-1263.
[21] 寇菲,黄晓霞,徐德秋.人血清Irisin和SFRP5水平变化与2型糖尿病合并肥胖患者的关系研究[J].国际免疫学杂志,2020,43(1):37-41.
[22] 代成刚,陈广,杨俊杰,等.针刺联合西格列汀对肥胖2型糖尿病患者脂联素,adropin及irisin的影响[J].辽宁中医杂志,2019,46(10):162-165.