宫颈癌是多因素、多基因、多步骤共同作用下形成的一个连续复杂的病理过程,其发病率仅次于乳腺癌,亦是全球女性癌症死亡的第3大原因[1-2],高危型人乳头瘤病毒(high risk-human papillomavirus,HR-HPV)感染是其发生、发展的主要致病因素[3-4]。其中HPV 16、52、58、18是我国女性HR-HPV感染最常见亚型,已有研究证实[5],人乳头瘤病毒(human papillomavirus,HPV) 16、18是最主要的两种致癌性HPV,均与高级别鳞状上皮内病变(high grade squamous intraepithelial lesion,HSIL)发生、发展密切相关,但单独HPV 52、58与宫颈病变程度相关性的临床研究较少,有待进一步深入研究。有研究指出[6],HSIL患者通过宫颈锥切术后可达到获取组织样本的同时兼顾诊断与治疗双重目的,但由于部分高级别病灶具有多发性,4.0%~16.0%患者宫颈锥切术后复发,易增加二次手术风险。因此,寻找HSIL患者宫颈锥切术后复发的高危因素,对实施个体化治疗及预后判断具有较高临床价值。基于此,本研究分析HPV 52、58与宫颈病变的相关性,探讨宫颈锥切术后HSIL患者复发的高危因素,为评估宫颈病变进展及预后,指导制定个性化随诊与治疗方案提供循证支持。详情报告如下。
1 资料与方法
1.1 一般资料 选取2015年12月—2019年4月河北省廊坊市人民医院收治的宫颈病变患者287例作为研究对象,年龄28~69岁,平均(45.96±7.28)岁;病程3~7个月,平均(4.62±0.50)个月;绝经104例;根据宫颈锥切术后病理学检查结果分为宫颈炎症组(34例)、低级别鳞状上内病变(low-grade squamous intraepithelial lesions,LSIL)组(58例)、HSIL组(180例)、宫颈浸润癌组(15例)。纳入标准:①均经宫颈锥切术后病理学检查证实;②符合宫颈锥切术适应证;排除标准:①处于妊娠期、分娩期或哺乳期等特殊时期女性;②合并肝肾等重要脏器器质性病变者;③生殖道畸形或全身感染性疾病者;④既往有盆腔放化疗史或宫颈切除史者;⑤精神行为异常者。
本研究经医院伦理委员会审核通过,所有研究对象均知情同意并签署知情同意书。
1.2 方法 取膀胱截石位,充分显露宫颈,宫颈取样刷在宫颈管口鳞状上皮细胞及柱状上皮细胞交界处旋转3~5圈,将毛刷置入细胞保存液内(含有生理盐水)送检。应用HPV检测分型核酸试剂盒,严格按照广东凯普生物科技股份有限公司提供的试剂盒说明书操作,包括16种高危亚型(HPV16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、CP8304)、7种低危亚型(6、11、25、41、42、43、44)。提取宫颈分泌物DNA,利用加热法将DNA分解为单链核苷酸,实施PCR扩增,扩增条件:20 ℃静置10 min,95 ℃预变性9 min,94 ℃变性20 s,55 ℃退火30 s,72 ℃延伸30 s,共循环40次,最后72 ℃延伸5 min。后通过探针DNA(多色荧光标记)与扩增单链核苷酸杂交,收集荧光信号,反应结束后,电脑自动分析处理数据。
1.3 观察指标 ①统计HPV感染情况,比较4组HPV感染率、HPV单一感染情况与多重感染情况。②比较4组HR-HPV感染亚型分布情况。③180例HSIL患者宫颈锥切术后12个月复发率为16.11%(29/180)。采用基线资料调查表收集HSIL组术后复发与未复发患者基线资料[年龄、体重指数(body mass index,BMI)、饮酒史、吸烟史、锥切方式、产次、锥切深度、累及腺体、术后切缘状态、绝经状态、多象限受累、宫颈转化区分型]、HR-HPV感染情况。其中术后12个月后组织病理学检查再次出现HSIL定义为复发;BMI<18.5 为偏瘦;18.5 ≤BMI<24.0 为正常;24.0≤BMI<28.0 为超重;BMI≥28.0为肥胖;术后HR-HPV阳性,并经再次验证结果显示单一感染者与初次基因型相同,多重感染者至少与初次基因型之一相同为HR-HPV持续感染。④分析HSIL患者宫颈锥切术后复发的影响因素。
1.4 统计学方法 应用SPSS 22.0统计学软件处理数据。计量资料比较采用t检验;计数资料比较采用χ2检验;等级资料比较采用Ridit检验;影响因素确定采用Logistic多因素回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 HPV感染情况 287例CIN患者中HPV阳性262例,总感染率为91.29%(262/287),其中单一HPV感染率为65.16%(187/287),包括单一HR-HPV感染率为63.76%(183/287),单一低危HPV感染率为1.39%(4/287);多重HPV感染率为26.13%(75/287),包括多重HR-HPV感染率为23.00%(66/2287),多重低危HPV感染率为3.14%(9/287),见图1。4组总HRV感染率、HRV多重感染率差异有统计学意义(P<0.05),见表1。
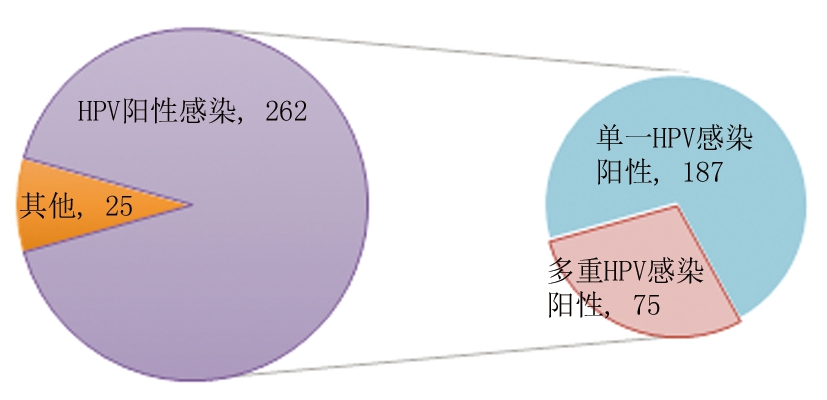
图1 HPV感染情况
Figure 1 HPV infection
表1 4组HPV感染情况、HPV单一感染情况与
多重感染情况比较
Table 1 Comparison of HPV infection,HPV single
infection and multiple infection in four groups (例数,%)
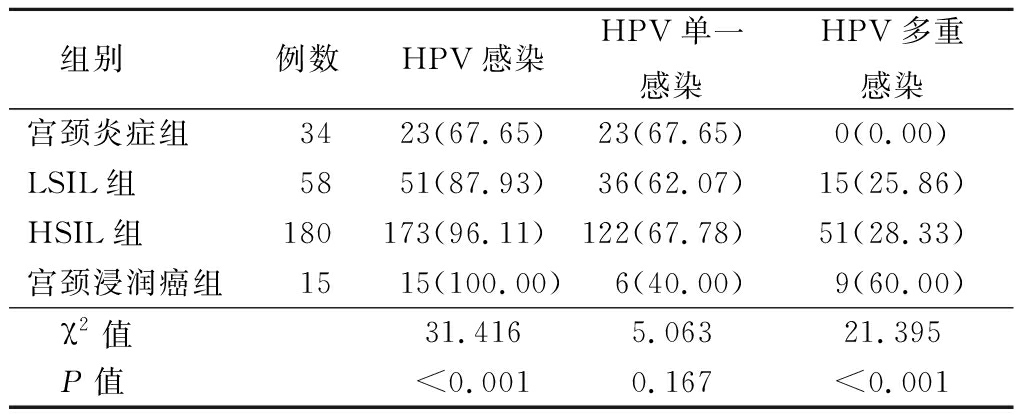
组别例数HPV感染HPV单一感染HPV多重感染宫颈炎症组3423(67.65)23(67.65)0(0.00)LSIL组5851(87.93)36(62.07)15(25.86)HSIL组180173(96.11)122(67.78)51(28.33)宫颈浸润癌组1515(100.00)6(40.00)9(60.00)χ2值31.4165.06321.395P值<0.0010.167<0.001
2.2 4组HR-HPV感染亚型分布情况 262例HPV感染阳性共检出23种亚型,其中HRV 52、58感染率相对其他亚型感染率较高。4组HRV 52、58、16、18感染率差异有统计学意义(P<0.05),见表2。
表2 4组HR-HPV感染亚型分布情况比较
Table 2 Comparison of the distribution of HR-HPV
infection subtypes in four groups (例数,%)
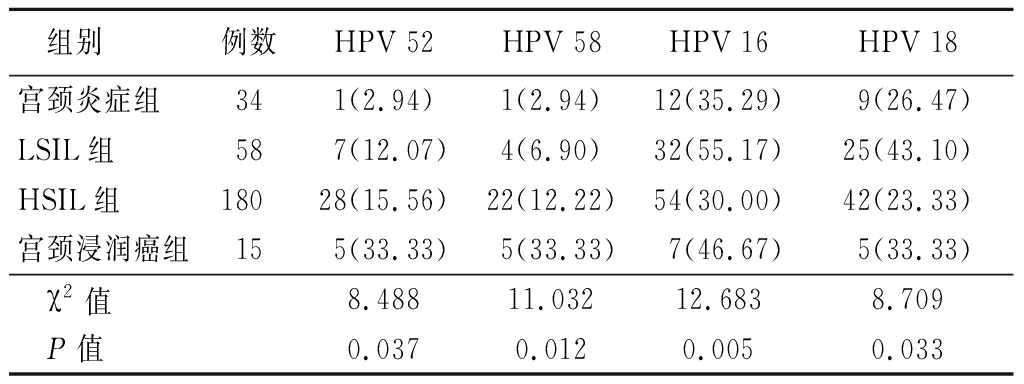
组别例数HPV 52HPV 58HPV 16HPV 18宫颈炎症组341(2.94)1(2.94)12(35.29)9(26.47)LSIL组587(12.07)4(6.90)32(55.17)25(43.10)HSIL组18028(15.56)22(12.22)54(30.00)42(23.33)宫颈浸润癌组155(33.33)5(33.33)7(46.67)5(33.33)χ2值8.48811.03212.6838.709P值0.0370.0120.0050.033
2.3 HSIL组术后复发与未复发患者基线资料、HR-HPV感染情况 HSIL组术后复发与未复发者术后切缘状态、绝经状态、多象限受累、术后HR-HPV持续感染、术后HR-HPV持续感染亚型、宫颈转化区分型差异有统计学意义(P<0.05),HSIL组术后复发与未复发者年龄、BMI、饮酒史、吸烟史、锥切方式、产次、锥切深度、累及腺体差异无统计学意义(P>0.05)。见表3。
表3 比较HSIL组术后复发与未复发患者基线资料、HR-HPV感染情况
Table 3 Comparison of baseline data and HR-HPV infection of patients with and without
postoperative recurrence in the HSIL group (例数,%)
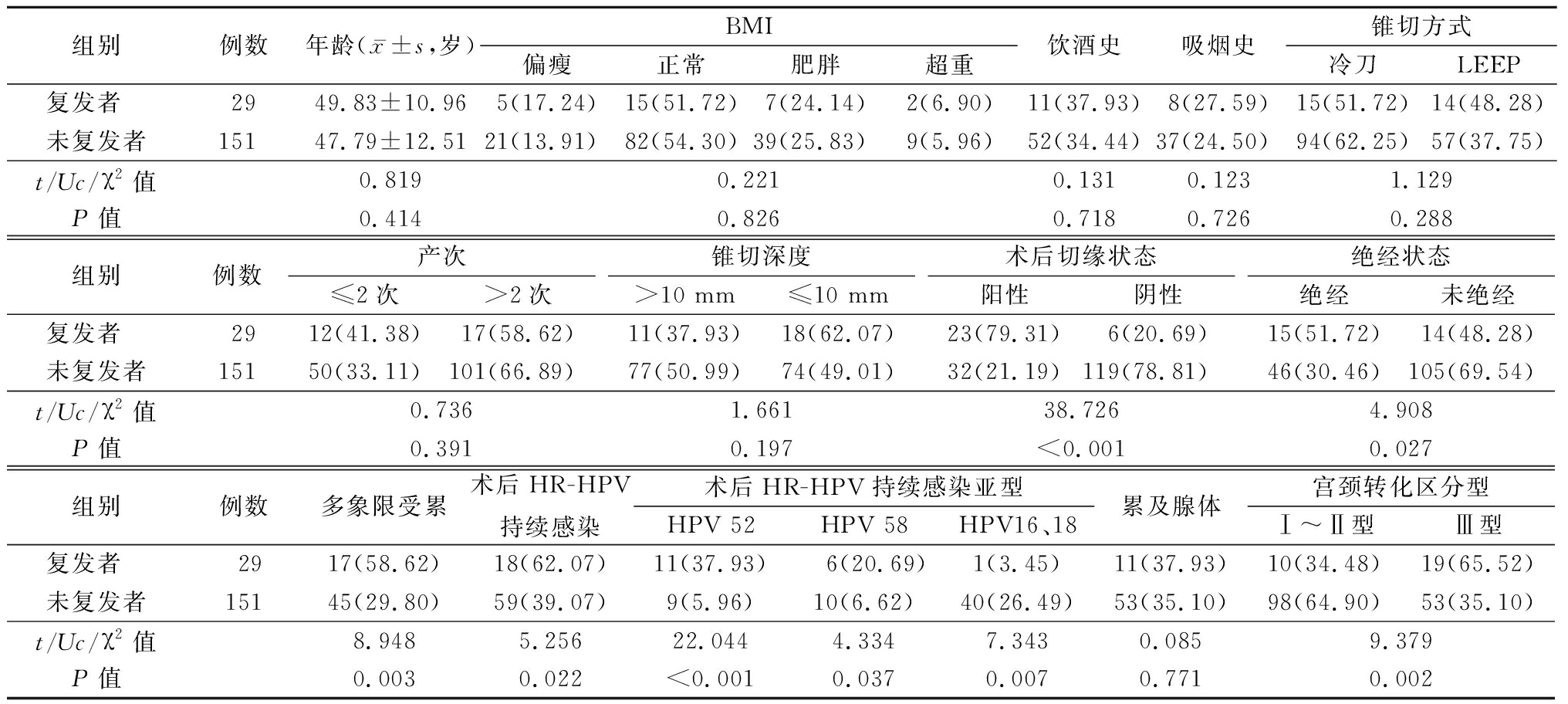
组别例数年龄(x-±s,岁)BMI偏瘦正常肥胖超重饮酒史吸烟史锥切方式冷刀LEEP复发者 2949.83±10.965(17.24)15(51.72)7(24.14)2(6.90)11(37.93)8(27.59)15(51.72)14(48.28)未复发者15147.79±12.5121(13.91)82(54.30)39(25.83)9(5.96)52(34.44)37(24.50)94(62.25)57(37.75)t/Uc/χ2值0.8190.2210.1310.1231.129P值0.4140.8260.7180.7260.288组别例数产次≤2次>2次锥切深度>10 mm≤10 mm术后切缘状态阳性阴性绝经状态绝经未绝经复发者 2912(41.38)17(58.62)11(37.93)18(62.07)23(79.31)6(20.69)15(51.72)14(48.28)未复发者15150(33.11)101(66.89)77(50.99)74(49.01)32(21.19)119(78.81)46(30.46)105(69.54)t/Uc/χ2值0.7361.66138.7264.908P值0.3910.197<0.0010.027组别例数多象限受累术后HR-HPV持续感染术后HR-HPV持续感染亚型HPV 52HPV 58HPV16、18累及腺体宫颈转化区分型Ⅰ~Ⅱ型Ⅲ型复发者 2917(58.62)18(62.07)11(37.93) 6(20.69)1(3.45)11(37.93)10(34.48)19(65.52)未复发者15145(29.80)59(39.07)9(5.96)10(6.62)40(26.49)53(35.10)98(64.90)53(35.10)t/Uc/χ2值8.9485.25622.0444.3347.3430.0859.379P值0.0030.022<0.0010.0370.0070.7710.002
2.4 HSIL患者宫颈锥切术后复发的影响因素分析 以宫颈锥切术后12个月后复发(未复发=0,复发=1)为因变量,纳入术后切缘状态(阴性=0;阳性=1)、绝经状态(未绝经=0;绝经=1)、多象限受累(否=0;是=1)、术后HR-HPV持续感染(否=0;是=1)、术后HR-HPV持续感染亚型(HPV16、18=0;HPV 52=1;HPV 58=2)、宫颈转化区分型(Ⅰ~Ⅱ型=0;Ⅲ型=1)作为自变量,采用非条件逐步回归分析,结果显示,术后切缘状态、绝经状态、多象限受累、术后HR-HPV持续感染、术后HR-HPV持续感染亚型、宫颈转化区分型是HSIL患者宫颈锥切术后复发的影响因素(P<0.05)。术后切缘阳性者宫颈锥切术后复发风险可能是术后切缘阴性者的2.559倍;绝经者宫颈锥切术后复发风险可能是未绝经者的1.967倍;多象限受累者宫颈锥切术后复发风险可能是无多象限受累者的2.030倍;术后HR-HPV持续感染者宫颈锥切术后复发风险可能是术后HR-HPV未持续感染者的2.002倍;术后HPV 52感染者宫颈锥切术后复发风险可能是术后其他HR-HPV感染亚型者的1.759倍;术后HPV 58感染者宫颈锥切术后复发风险可能是术后其他HR-HPV感染亚型者的1.831倍;宫颈转化区分型Ⅲ型者宫颈锥切术后复发风险可能是宫颈转化区分型Ⅰ~Ⅱ型者的1.951倍。见表4。
表4 HSIL患者宫颈锥切术后复发影响因素
Table 4 Influencing factors of recurrence after cervical conization in HSIL patients
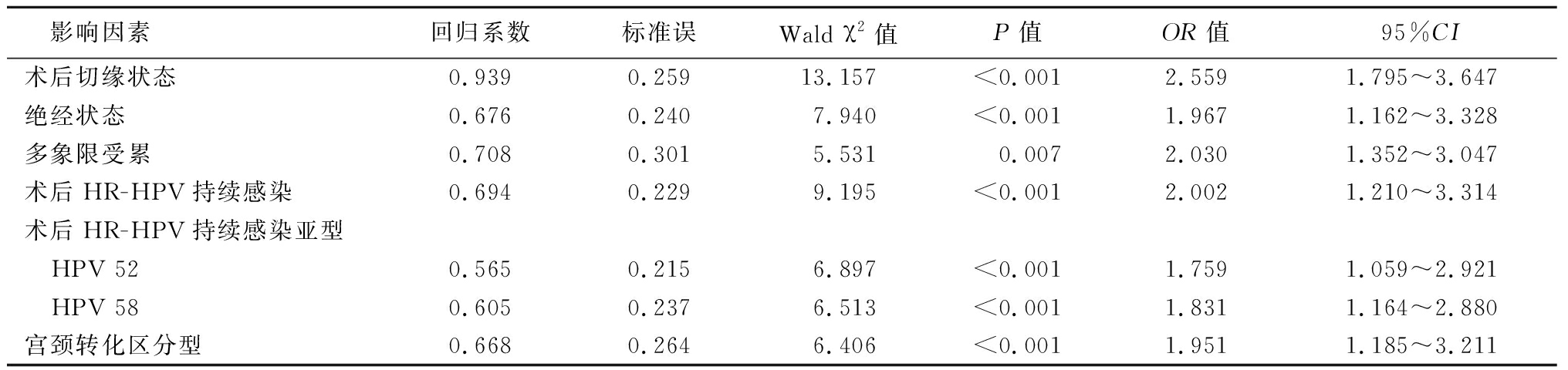
影响因素回归系数标准误Wald χ2值P值OR值95%CI术后切缘状态0.9390.25913.157<0.0012.5591.795~3.647绝经状态0.6760.2407.940<0.0011.9671.162~3.328多象限受累0.7080.3015.5310.0072.0301.352~3.047术后HR-HPV持续感染0.6940.2299.195<0.0012.0021.210~3.314术后HR-HPV持续感染亚型 HPV 520.5650.2156.897<0.0011.7591.059~2.921 HPV 580.6050.2376.513<0.0011.8311.164~2.880宫颈转化区分型0.6680.2646.406<0.0011.9511.185~3.211
3 讨 论
3.1 HPV 52、58与宫颈病变 受宿主、病毒、细胞等因素影响,即使感染同一类型HPV,其生物学行为在不同病变中亦有不同[7]。因此,分析不同级别病变HR-HPV感染情况,有助于指导临床防治宫颈癌及其癌前病变。本研究结果显示,287例宫颈病变患者中单一HR-HPV感染率为63.76%,多重HR-HPV感染率为23.00%。蒋盈盈等[8]调查研究显示,女性宫颈HR-HPV感染率为21.01%,本研究结果感染率略高,可能与HSIL纳入样本量不同有关。另外,宫颈病变中HR-HPV不同型别分布不同。除HPV 16外,HPV 52、58是我国HPV感染的主要型别[9]。Kim 等[10]采用实时聚合酶链反应发现,HPV 58型可作为HSIL或宫颈癌的诊断生物标志物。本研究结果显示,HPV 52、58感染率分别为15.83%、12.36%。提示HPV感染亚型及感染率具有地区差异,可为宫颈癌预防提供流行病学依据。进一步比较不同级别宫颈病变患者HR-HPV感染亚型发现,HPV 52、58感染率随宫颈病变程度加重出现上升趋势。说明HPV 52、58感染与宫颈病变进展有关,这可能是由于HPV 52、58感染后,HPV编码E6、E7蛋白抑制凋亡通路,改变细胞周期,影响机体免疫应答,进而诱发HR-HPV持续感染,从而增加宫颈细胞学病变发生风险。由此可见,临床除需高度重视HPV 16、18外,还应加强HPV 52、58感染患者管理,便于及早筛查宫颈病变高危人群,提高HSIL及宫颈癌检出率。
3.2 HSIL患者宫颈锥切术后复发的危险因素 研究发现[11],宫颈锥切术后切缘阳性HSIL患者宫颈病变再次发生风险约是切缘阴性患者的5.5倍。本研究纳入180例HSIL患者,探讨影响其宫颈锥切术后复发的相关因素,结果显示,术后切缘阳性者宫颈锥切术后复发风险可能是术后切缘阴性者的2.559倍。结合潘嘉佳等[12]、王静等[13]的研究考虑可能与宫颈锥切术中反复电凝止血操作可引起阴道酸性环境紊乱,破坏新生细胞有关。宋琳等[14]通过回顾性收集309例宫颈上皮内瘤变患者临床资料发现,绝经是宫颈上皮内瘤变锥切术后复发的重要因素,本研究结果支持此观点。这可能归因于绝经患者体内雌激素水平显著降低,一方面可加快宫颈萎缩,促使宫颈鳞柱交界回缩,导致术后病灶残留;另一方面可降低生殖系统保护功能,影响局部HPV清除功能,导致HPV反复感染,从而提高宫颈癌变发生风险[15-16]。因此,加强绝经期女性监护与管理尤为重要。另外,多象限受累、宫颈转化区分型Ⅲ型也会增加HSIL患者宫颈锥切术后复发风险,与金屏[17]研究结果相似,这可能是由于多象限受累患者病灶呈多中心分布,易诱导转化区延伸至宫颈深部,滋生深部病灶,增加手术难度,致使宫颈锥切术后病灶残留,从而增加复发风险。由此可知,建议术前采用彩色多普勒超声诊断仪仔细扫描HSIL患者病变部位,掌握宫颈病变累及范围与病灶数目,完善手术方案,以减少术后病灶残留。此外,本研究Logistic多因素回归分析结果显示,术后HPV 52、58持续感染是HSIL患者宫颈锥切术后复发的危险因素,这可能是由于HPV 52、58持续感染可诱导细胞免疫监控逃逸,降低宫颈局部免疫功能,减弱自身清除病毒能力,影响细胞正常衰老与凋亡,加之个体易感性显著升高,进而增高HSIL患者复发风险。建议临床术后应密切监测患者HR-HPV感染状态,并将HPV 52、58感染者纳入高危人群,进行密切随访,警惕HSIL复发。
综上所述,不同宫颈病变患者HPV 52、58感染率差异有统计学意义,有助于指导临床评估宫颈锥切术后疗效、预后,为防治宫颈癌及其癌前病变、寻找更合理临床诊疗策略提供科学参考。
[1] 石杏先,余立群,高国兰.318例高级别宫颈上皮内瘤变及宫颈癌患者的TCT和hrHPV检测分析[J].中国肿瘤临床,2019,46(2):73-76.
[2] 李洋,李永丽,王芦萍.HPV感染型别及多重感染对宫颈病变的影响[J].中华医院感染学杂志,2019,29(22):3461-3464,3472.
[3] Li Y,Liu J,Gong L,et al. Combining HPV DNA load with p16/Ki-67 staining to detect cervical precancerous lesions and predict the progression of CIN1-2 lesions[J]. Virol J,2019,16(1):117.
[4] Mboumba Bouassa RS,Nodjikouambaye ZA,Sadjoli D,et al. High prevalence of cervical high-risk human papillomavirus infection mostly covered by Gardasil-9 prophylactic vaccine in adult women living in N′Djamena,Chad[J]. PLoS One,2019,14(6):e0217486.
[5] 张师前,石比伯.高危型HPV检测在子宫颈病变筛查中的价值[J].实用妇产科杂志,2020,36(10):726-729.
[6] 聂明月,叶红.子宫颈上皮内瘤变Ⅲ级冷刀锥切术后病理升级的高危因素分析[J].实用妇产科杂志,2019,35(7):518-521.
[7] Long W,Yang Z,Li X,et al. HPV-16,HPV-58,and HPV-33 are the most carcinogenic HPV genotypes in Southwestern China and their viral loads are associated with severity of premalignant lesions in the cervix[J]. Virol J,2018,15(1):94.
[8] 蒋盈盈,徐玮,陶俊贞.高危人乳头瘤病毒感染状况及其与宫颈病变的相关性分析[J].中国妇幼健康研究,2020,31(5):671-675.
[9] 吴颖,曹芬芳,刘太林,等.湖南地区7 076例女性HPV感染情况及分型分析[J].实用预防医学,2019,26(4):474-477.
[10] Kim J,Kim BK,Jeon D,et al. Type-specific viral load and physical state of HPV type 16,18,and 58 as diagnostic biomarkers for high-grade squamous intraepithelial lesions or cervical cancer[J]. Cancer Res Treat,2020,52(2):396-405.
[11] Chen JY,Wang ZL,Wang ZY,et al. The risk factors of residual lesions and recurrence of the high-grade cervical intraepithelial lesions(HSIL) patients with positive-margin after conization[J]. Medicine(Baltimore),2018,97(41):e12792.
[12] 潘嘉佳,郑小冬,杨洁,等.初次宫颈锥切术后残留的预测因素及后续处理探讨[J].中国医师进修杂志,2020,43(9):829-835.
[13] 王静,陈少科,陈复刚,等.宫颈锥切术后切缘状态及病变残留危险因素分析[J].中国妇产科临床杂志,2019,20(3):234-236.
[14] 宋琳,史玉爽.宫颈高级别上皮内瘤变患者行锥切术后复发相关因素分析及干预对策研究[J].中国妇产科临床杂志,2019,20(3):270-271.
[15] 王明宇,程广艳,张雯雯,等.宫颈锥切术后病变残留的危险因素分析[J].肿瘤预防与治疗,2020,33(5):423-427.
[16] 陈梽烈.锥切术后高级别子宫颈鳞状上皮内病变切缘阳性及二次手术病灶残留的相关因素研究[J].中国医学创新,2020,17(36):125-129.
[17] 金屏.CIN Ⅱ~Ⅲ级患者宫颈锥切术后病变残留的高危因素探讨[J].中国性科学,2020,29(3):36-38.