血栓弹力图(thromboelastography,TEG)是德国Hartert 博士在海德堡发明的一种研究工具[1],20世纪80年代开始广泛用于临床指导术中输血,现已成为各种疾病凝血功能监测的重要指标。目前,新型实时监测TEG(TEG6S系统),使用共振频率黏弹性测量和一次性多通道微流体腔来评估止血,与传统的TEG相比,能提供更精确的结果[2]。常规凝血功能检查包括凝血酶原时间和国际标准化比值(prothrombin time/international normalized ratio,PT/INR),活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、纤维蛋白原(fibrinogen,FIB),凝血酶时间(thrombin time,TT),其耗时较长,不能准确的反映血凝块的微小变化,而TEG操作简便,快速,大约30 min内便能得到结果,其结果的各个参数可以准确反映凝血状态。在出血性疾病中,目前还没有能及时检测血小板功能和纤维蛋白溶解的快速标准化检查,TEG能够得出较全面的凝血和纤溶状况,能区分低凝、高凝、纤溶亢进症状,评估出血及指导成分输血。
1 TEG的使用
TEG的工作原理是基于体外凝血过程而进行的。在完成消毒后,用枸橼酸钠1∶9的抗凝真空釆血管采集患者静脉血,得到的全血标本颠倒混匀,枸橼酸钠通过与血样中钙离子螯合而起抗凝作用。仪器: Haemoscope 5000 TEG分析仪,测试前先作校准。打开配套试剂盒,安装好圆柱形塑料反应杯及盖子。在37 ℃下使用移液器取1 mL全血注入试剂盒里的高凝土试管中,颠倒混匀充分。取20 μL的CaCl2,注入反应杯中,再从混匀的试管中取340 μL全血注入反应杯中,将通道调至运行状态。盛有血液的圆柱形杯,以4°45'的角度旋转,每次转动持续10 s[3]。杯子正中心上方有一个探针,伸入标本中,通过反应杯顺时针逆时针交替旋转过程中探针感受到的力的变化传导给仪器,并记录下来以图的形式呈现出来。在血液没有凝固的时候为两条重叠的直线,开始凝固后,直线向上下两侧开口,形成有弧度的曲线,达到峰值后,线开始缓慢向中心位置延伸,30 min左右趋近稳定。
从图形中曲线可以得出相关参数的数值(图1)。R是凝血过程开始所需的时间(以min为单位),K为曲线幅值达到20 mm的时间,α角是纤维蛋白凝块形成及加固的速率MA(maximal amplitude) 是最大振幅,表示血凝块的最大强度,LY30为MA达到30 min后曲线下面积减小的百分比,反映纤维蛋白溶解速率。监测凝血过程的一个优势就是可以制定个体化的临床输血方案。由于不同的的参数反映不同的凝血阶段,方案可以是个体化的,而且治疗后反复检测可以评估治疗的效果[4]。R值的延长提示凝血因子缺乏,若不是肝素治疗所致,则应输入含有正常凝血因子的血浆可逆转病理。如果肝素与血浆输注联合使用,则可使延长的R值恢复正常。α角减少提示纤维蛋白原不足,可通过浓缩纤维蛋白原或血浆予以纠正,可根据临床情况做出判断。MA低表明血小板功能降低,同样,基于对个别患者的了解,可以提示使用加压素和(或)血小板浓缩物。
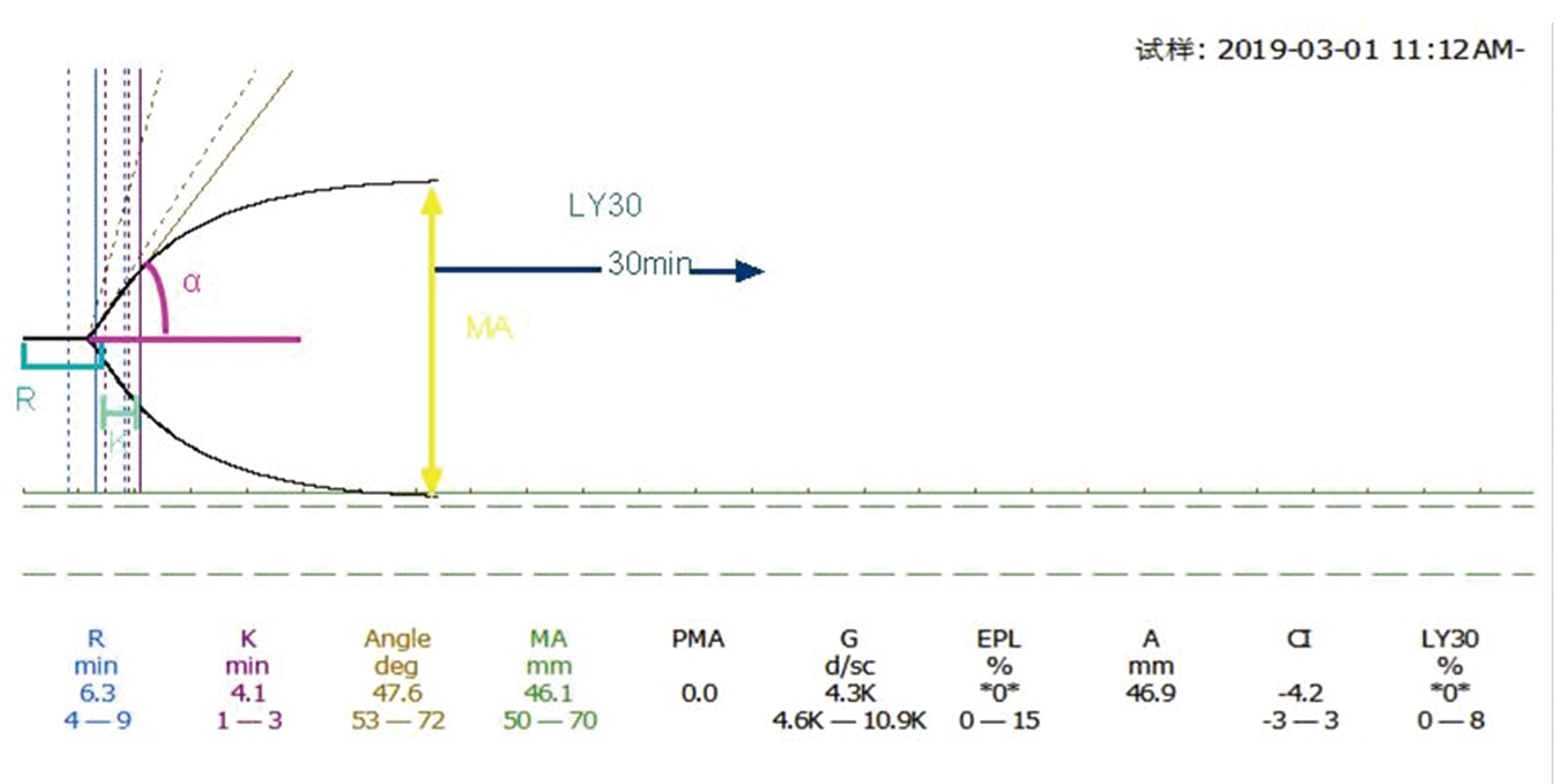
图1 TEG结果示例
2 TEG在临床输血中的应用
2.1 肝移植中输血 凝血因子中除组织凝血活酶和钙离子外,多数凝血因子或其中间产物是由肝脏合成的。肝实质细胞可以合成纤维蛋白原,肝细胞微粒体可以合成凝血酶原、因子Ⅶ和因子Ⅹ。因子Ⅷ、因子Ⅸ和因子Ⅴ等也在肝脏中合成。同时,肝脏也会产生抗凝物质及促进纤维蛋白溶解的纤溶酶原,以保持血液系统出血与止血的动态平衡。轻度的肝功能损伤,肝细胞代偿性反应可以基本维持正常的肝功能,严重肝功能衰竭患者凝血功能明显紊乱,使患者暴露于凝血病和潜在的危及生命的出血。门静脉高压除了破坏促凝和抗凝因子外,还会增加出血的风险。肝衰竭时血小板和内皮功能的改变也可能延缓血栓的形成。此外,肝功能衰竭患者可出现高纤溶、纤维蛋白原异常血症和肾功能衰竭,这可能进一步增加出血时间延长的风险。肝功能衰竭也与血小板减少有关,这可能是由于门静脉高压相关脾功能亢进和血小板生成素代谢改变或抗血小板抗体的存在所致[5]。
尽管在肝脏研究方面取得了许多进展,但肝移植仍然是终末期肝病的唯一治疗方法[6]。肝移植早期,大出血并不少见,大量同种异体血液成分输注止血复苏。考虑常规血浆输血的替代方案对于改善中至重度凝血功能障碍的复杂肝移植患者的止血复苏是非常重要的[7]。避免异基因血液成分在某些患者中是可行的,但对于因出血、血液稀释、低体温和酸碱紊乱而发生复杂凝血病变的患者,可能需要多模式凝血治疗[8]。因此输血中应重点考虑成分输血。
常规的输血前凝血检查均使用血浆,没有考虑血小板功能和纤维蛋白形成等非血浆因素。此外,在严重的肝病中,这些检测可能会改变促凝血平衡和抗凝血平衡的紊乱。在重症监护病房,INR被用作凝血功能障碍的替代指标,但INR变化很大,在肝衰竭患者中存在较大的变异性,单独的INR并不能特别预测出血风险,可能导致新鲜冷冻血浆(fresh frozen plasma,FFP)的过度输注,这可能与容量过载和急性肺损伤有关[9]。此外,INR易受PT试剂在实验室使用的显著变化影响,而PT/INR在直接Xa因子或凝血酶抑制剂抗凝期间表现出不可预测的变化[5]。TEG与传统凝血研究相比具有明显优势,它使用全血而不是血浆,在样本采集后几分钟内提供实时结果,并提供关于血栓形成动态和血栓强度的信息,因此围手术期使用TEG指导FFP的输注已被广泛认可[5]。TEG检测结果中,提供了对血栓形成和随后纤维蛋白溶解的动力学和强度的信息。R值为检测开始到第一个纤维蛋白凝块形成振幅达2 mm所用的时间,表现了凝血酶等凝血因子充分激活形成纤维蛋白所需的时间,反应凝血因子的活性。R值延长表示低凝,凝血因子缺乏,可通过注射FFP而纠正。R值缩短表示高凝,凝血因子活性较强,血液呈高凝状态,需要用抗凝药物纠正。α角为血凝块形成至图形最大曲线弧度作切线与水平线的夹角,数值越大,说明血凝块形成越快;数值越小,说明最大血凝块强度的形成延迟或受损。MA是血凝块的最大强度或硬度及血凝块形成的稳定性,主要受纤维蛋白及血小板影响,血小板质量或数量的异常都会影响。MA增大提示血小板功能强,易形成血栓,需要抗血小板治疗。MA减小提示血小板功能弱,易出血,需补充血小板进行纠正。TEG优于传统的凝血检查,利用全血而非血浆,在采集样本后30 min内提供实时结果,并提供关于血凝块形成动力学和血栓强度的信息[5]。TEG为血凝块稳定性和纤溶系统提供了重要的信息,为准确的进行红细胞、血小板和FFP等成分输血提供了更有力的依据。
2.2 心脏疾病输血 心脏是人体重要的泵血器官,当心脏有先天疾病或发生不可逆的衰竭和损伤时, 心脏外科手术是挽救生命和提高生存率的常见外科手术。最近有研究表明,接受心脏手术的患者中有20%~60%接受围手术期输血。低至一个单位的输血量已被证明会影响发病率和病死率,而输血量的增加通常会导致严重的结果[10]。合理的输血前检测成为心脏疾病输血的关键。
越来越多的研究证实大量失血和输血与心脏外科患者的发病率和病死率有关,及时发现凝血异常,进行有效的止血复苏,减少发病率和病死率至关重要[11]。有研究TEG对围手术期输血率的影响表明,所有接受复杂心脏手术的患者,包括开放多瓣膜修复/置换术、冠状动脉旁路移植术合并开放瓣膜修复/置换术、主动脉弓/根尖修复术前和术后的患者,使用TEG监测后,红细胞、血浆和冷沉淀的平均输入量均显著降低(P<0.001),血小板的使用减少,但未达到显著水平[12]。围手术期和整个住院期间所有血液制品的平均单位减少约40%(两者均P<0.001),输血患者总比例明显降低(P<0.01)[13]。在儿童心脏手术中,由TEG确定的目标导向血液替代品的使用使成分输血治疗得以优化,有效纠正了凝血异常,致使心脏直视手术后1,2和24 h胸腔引流量显著减少,并且术后间隔期内总血制品需求量减少。此外,TEG指导的个体化血小板输注治疗可减少儿童心脏手术中的出血风险,同时减少不必要的血小板输血[14]。在心脏手术实时监测中,使用TEG引导的凝血治疗,可以针对特定止血药物,凝血因子浓缩物和血液制品进行治疗的方法。因此,它导致更平衡的输血方案,减少血液制品的用量,从而可能降低与不加控制地使用不必要的输血相关的血栓栓塞事件的发生率。
2.3 产后输血 妊娠期血液中的凝血因子Ⅱ、Ⅴ、Ⅶ、Ⅷ、Ⅸ、Ⅹ等均增加,至妊娠中晚期可达正常人1.5~2.0倍,凝血因子Ⅺ活性降低。纤维蛋白肽A、纤维蛋白肽B、凝血血球蛋白原、血小板因子Ⅳ及纤维蛋白原明显增加,而抗凝血酶Ⅲ和蛋白C、蛋白S下降。正常妊娠期间血液呈现高凝状态,使用TEG检测产后出血时,将血小板介导的凝块收缩与纤溶活性增高区分开来,从而减少分娩出血并发症的发生[15]。分娩时子宫肌肉收缩为最初出血因素,通过在血管中产生凝块阻断血流,当子宫肌肉收缩随后减少并最终停止时,凝血机制开始发挥止血功能。由于子宫收缩乏力、软产道裂伤、胎盘因素及凝血功能障碍等原因导致的产后出血并不少见。产后出血仍是全球孕产妇发病率和病死率的主要因素,且严重程度似乎在增加[16]。产后出血分为原发性出血(婴儿出生后24 h内最常见)或继发性出血(婴儿出生后24 h~6周)。目前产后出血仍然是世界范围内的一项重大挑战,每6 min就有一名妇女死亡,且主要发生在中低收入国家[17]。通过密切监测止血,凝血参数的异常可在出血后不久检测到。这可能有助于为经历产后大出血的妇女提供更有针对性的止血治疗,可能导致更好的孕产妇结局。使用TEG检测,可以快速获得凝血状态的信息,为急性出血患者进行实时监测凝血功能,在紧急情况下,为临床提供准确的结果,早期预防并发症的发生。
国际产科输血率从0.1%~1.9%,近年来有所上升,输血可以提高产妇的生存率[18]。产后输血在固定比例的基础上盲目输血可能会过度治疗或治疗不足[19]。此外,血液制品的使用并不能预测血小板输注的必要性。随着对积极使用血液制品的需求减少,使用实验室对血液制品的选择进行微调至关重要[19]。传统的实验室检测包括:血细胞比容、血小板计数、PT/INR、APTT、纤维蛋白原。而TEG可以提供动态全面的凝血功能评估,为产后输血提供更快捷和准确的分析,降低产妇产后出血病死率。
2.4 急性创伤输血 在急性创伤中往往会发生急性失血,当失血量达到1 000~1 500 mL(总血容量的20%~30%)时,可出现心血管症状及直立性低血压,如失血量达1 500~2 000 mL (总血容量的30%~40%),即使仰卧休息状态下也可出现明显症状:手足厥冷、面色苍白、口渴尿少、脉搏细速、血压降低、短暂意识丧失。失血量超过2 000~2 500 mL (总血容量的40%~50%),则可出现严重的失血性休克,如处理不当可导致死亡。大量失血是受伤后48 h内最常见的死亡原因,大约1%~3%的严重创伤患者需要输血,包括红细胞、FFP和血小板,以稳定其血流动力学状态[20]。
基于对止血过程和细胞贡献(尤其是血小板)对完整血栓形成和稳定的重要性的更好理解,以及增强纤溶对患者出血和预后的关键作用,对创伤患者凝血功能的监测从基于血浆的检测(如APTT和PT/INR),转变为全血黏弹性止血检测即TEG和旋转血栓弹力图(rotation thromboelastogram,ROTEM)[21]。在关于老年人创伤输血方面,有研究得出老年患者似乎比年轻患者更需要输血,老年人多处于高凝状态,故创伤性凝血异常也会发生在老年人群中,为了快速诊断急性创伤性凝血功能障碍,越来越多的人开始使用TEG 进行实时凝血功能障碍检测,这些检测能够提供凝血状态的快速测定,并有助于指导输血。在创伤患者成分输血的研究方面,研究证实TEG可以在创伤人群中以目标导向的方式指导创伤后大量输血,创伤性脑损伤及脑出血的诊断和管理,血小板拮抗剂对创伤患者的治疗,重组FVⅡa的利用,和终末期创伤患者器官捐献中凝血功能障碍的处理方面的作用非常重要[22]。以及TEG引导下创伤患者采用纤维蛋白原浓缩物和凝血酶原复合物浓缩物的止血疗法而减少红细胞或血小板浓缩物的输血治疗方面也有至关重要的作用。
3 应用前景
血液制品是有限的资源。一些研究表明,使用TEG可以减少输血的需要,在提供更有针对性的输血治疗中发挥重要作用[23]。使用TEG的靶向输血治疗可以减少输血,可能逆转创伤诱导的凝血病,基于TEG的输血计算可以帮助减少输血时血液消耗,特别是在心脏手术中[24]。在产后出血或意外情况下的大出血时,也可以通过TEG和其他凝血检测评估患者的凝血状态来指导进一步的输血治疗,利用血液替代品输注或成分输血来降低输血量达到产后出血的治疗。在血库血液制品管理中,TEG作为出血早期诊断预测因子,监测早期出血,评估凝血状态,为优化急性输血包的使用和目标导向的血液成分治疗而采取的措施将有助于更好的患者血液管理,降低输血需求。TEG提供的最重要的数据是血凝块强度和纤维蛋白溶解。凝块强度测量可以确定出血是否由凝血病引起,是基于血栓形成的输血算法的关键信息[25]。TEG是为数不多的诊断和量化纤维蛋白溶解的试验之一,从而指导抗纤维蛋白溶解药物和血液制品的使用(如冷沉淀和纤维蛋白原浓缩物),还可能诊断血小板功能障碍,并可能防止对非凝血患者不恰当地输血。
4 总 结
越来越多的人认为,基于血浆的凝血筛选试验,如APTT和PT/INR,不适合监测凝血异常,为患者提供针对性、个体化的凝血治疗或指导输血治疗。为了对全血进行分析以准确识别相关凝血异常及指导创伤输血,黏弹性止血试验,如TEG和ROTEM越来越受到人们的关注。TEG作为目前比较成熟的监测,动态反映凝血过程,比较全面的监测凝血情况,判断输血需求,被广泛应用于各个科室的临床输血前的评估。目前,各大血库的血资源都比较匮乏,合理输血尤为重要,在心脏手术、肝移植及创伤中,它都被证明能减少血液制品的使用。随着技术的革新,TEG 6s系统是第一个真正的实时监测TEG,它使用共振频率黏弹性测量和一次性多通道微流控腔来评估止血和抗血小板治疗的反应[26]。TEG 6s的精度测试在所有测量中产生了低变异性(CV:0%~13%)。与TEG5000相比,新的实时监测TEG 6s更易于使用,并提供精确的结果,是一种很有前途的设备,用于快速诊断止血监测和未来个性化治疗试验,减少出血和血栓形成[2],以及更好的指导临床输血。TEG 6s系统基于共振黏弹性方法,可用于心脏手术中的实时止血评估。TEG 6s可以在创伤患者的初始复苏阶段及时引导血液成分输注[27]。在输血中TEG结合其他检查共同指导输血会有更好的临床意义。
[1] Schmidt AE,Israel AK,Refaai MA. The utility of thromboelastography to guide blood product transfusion[J]. Am J Clin Pathol,2019,152(4):407-422.
[2] Neal MD,Moore EE,Walsh M,et al. A comparison between the TEG 6s and TEG 5000 analyzers to assess coagulation in trauma patients[J]. J Trauma Acute Care Surg,2020,88(2):279-285.
[3] 郭亚清,熊亮. 血栓弹力图和常规凝血三项在患者凝血功能检测中的对比分析[J]. 血栓与止血学,2018,24(4):548-551.
[4] Ram H,Fragneto RY. Rotational thromboelastometry(ROTEM)-enhanced transfusion strategy:Is it time to be specific and prospective?[J]. J Clin Anesth,2020,67:110034.
[5] Hawkins RB,Raymond SL,Hartjes T,et al. Review:The perioperative use of thromboelastography for liver transplant patients[J]. Transplant Proc,2018,50(10):3552-3558.
[6] Olivo R,Guarrera JV,Pyrsopoulos NT. Liver transplantation for acute liver failure[J]. Clin Liver Dis,2018,22(2):409-417.
[7] Thai C,Oben C,Wagener G. Coagulation,hemostasis,and transfusion during liver transplantation[J]. Best Pract Res Clin Anaesthesiol,2020,34(1):79-87.
[8] Chow JH,Lee K,Abuelkasem E,et al. Coagulation management during liver transplantation:use of fibrinogen concentrate,recombinant activated factor VII,prothrombin complex concentrate,and antifibrinolytics[J]. Semin Cardiothorac Vasc Anesth,2018,22(2):164-173.
[9] Intagliata NM,Davis J,Caldwell SH. Coagulation pathways,hemostasis,and thrombosis in liver failure[J]. Semin Respir Crit Care Med,2018,39(5):598-608.
[10] Garg AX,Badner N,Bagshaw SM,et al. Safety of a restrictive versus liberal approach to red blood cell transfusion on the outcome of AKI in patients undergoing cardiac surgery:a randomized clinical trial[J]. J Am Soc Nephrol,2019,30(7):1294-1304.
[11] Meesters MI,von Heymann C. Optimizing perioperative blood and coagulation management during cardiac surgery[J]. Anesthesiol Clin,2019,37(4):713-728.
[12] Fleming K,Redfern RE,March RL,et al. TEG-directed transfusion in complex cardiac surgery:impact on blood product usage[J]. J Extra Corpor Technol,2017,49(4):283-290.
[13] Redfern RE,Fleming K,March RL,et al. Thrombelastography-directed transfusion in cardiac surgery:impact on postoperative outcomes[J]. Ann Thorac Surg,2019,107(5):1313-1318.
[14] Emani S,Emani VS,Diallo FB,et al. Thromboelastography during rewarming for management of pediatric cardiac surgery patients[J]. Ann Thorac Surg,2021,S0003-4975(21)00364-7.
[15] Arnolds DE,Scavone BM. Thromboelastographic assessment of fibrinolytic activity in postpartum hemorrhage:a retrospective single-center observational study[J]. Anesth Analg,2020,131(5):1373-1379.
[16] Collins PW,Bell SF,de Lloyd L,et al. Management of postpartum haemorrhage:from research into practice,a narrative review of the literature and the Cardiff experience[J]. Int J Obstet Anesth,2019,37:106-117.
[17] McNamara H,Mallaiah S. Managing coagulopathy following PPH[J]. Best Pract Res Clin Obstet Gynaecol,2019,61:106-120.
[18] O′Brien KL,Shainker SA,Lockhart EL. Transfusion management of obstetric hemorrhage[J]. Transfus Med Rev,2018,32(4):249-255.
[19] Jackson DL,DeLoughery TG. Postpartum hemorrhage:management of massive transfusion[J]. Obstet Gynecol Surv,2018,73(7):418-422.
[20] Meneses E,Boneva D,McKenney M,et al. Massive transfusion protocol in adult trauma population[J]. Am J Emerg Med,2020,38(12):2661-2666.
[21] Baksaas-Aasen K,Van Dieren S,Balvers K,et al. Data-driven development of ROTEM and TEG algorithms for the management of trauma hemorrhage:a prospective observational multicenter study[J]. Ann Surg,2019,270(6):1178-1185.
[22] Sumislawski JJ,Christie SA,Kornblith LZ,et al. Discrepancies between conventional and viscoelastic assays in identifying trauma-induced coagulopathy[J]. Am J Surg,2019,217(6):1037-1041.
[23] Unruh M,Reyes J,Helmer SD,et al. An evaluation of blood product utilization rates with massive transfusion protocol:Before and after thromboelastography(TEG) use in trauma[J]. Am J Surg,2019,218(6):1175-1180.
[24] Redfern RE,Fleming K,March RL,et al. Thrombelastography-directed transfusion in cardiac surgery:impact on postoperative outcomes[J]. Ann Thorac Surg,2019,107(5):1313-1318.
[25] Peng HT,Nascimento B,Tien H,et al. A comparative study of viscoelastic hemostatic assays and conventional coagulation tests in trauma patients receiving fibrinogen concentrate[J]. Clin Chim Acta,2019,495:253-262.
[26] Robson JL,Dj WA,McCulloch TJ,et al. Correlation and agreement between the TEG(R) 5000 and the TEG(R) 6s during liver transplant surgery[J]. Anaesth Intensive Care,2019,47(1):32-39.
[27] Morton S,Galea J,Uprichard J,et al. The practicalities and barriers of using TEG6s in code red traumas:an observational study in one London major trauma centre[J]. CJEM,2019,21(3):361-364.