受脑血管疾病发病率升高,血管性痴呆的发病率也呈现持续升高的状态,而与本病相关的诊治研究不断增多,其中不乏疾病发生发展过程的疾病相关指标的表达变化研究,而对于此类指标的变化情况的掌握有助于疾病的诊治措施制定[1-2]。临床中与脑血管疾病及认知损伤相关的研究指标涉及较多,其中β-淀粉样蛋白及tau蛋白均是常见研究指标,但是临床中关于其在血管性痴呆中的检测意义差异有统计学意义[3-5],与疾病严重程度的关系研究也极为匮乏,另外miR相关指标在血管性痴呆患者中的检测研究不断增多的同时,也存在研究差异相对突出的情况。因此,本研究就β-淀粉样蛋白、tau蛋白及miR相关指标在血管性痴呆患者中的变化及与严重程度的关系进行探究,现报告如下。
1 资料与方法
1.1 一般资料 选取2019年1月—2020年6月山东省聊城市人民医院收治的血管性痴呆患者79例为观察组,同时期的体检健康者79例为对照组。对照组中包括男性41例,女性38例,年龄为53~77岁,平均(66.1±7.3)岁。观察组中包括男性43例,女性36例,年龄53~76岁,平均(66.3±7.0)岁,病程3.5~22.0个月,平均(10.1±2.9)个月,严重程度(CDR分级):轻度者39例,中度者25例,重度者15例。2组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会批准。
1.2 纳入标准及排除标准 纳入标准:男女不限;年龄在20岁及以上者;观察组为脑血管痴呆(CDR量表中的痴呆标准,且同时存在与之相关的脑血管疾病)者,对照组为健康体检者;研究对象和(或)家属对研究知情同意。
排除标准:脑外伤病史者;合并外周神经系统疾病者;合并感染者者;意识障碍者;其他神经系统疾病导致的认知障碍者;精神疾病史者;近期进行相关治疗者。
1.3 检测方法 采集2组研究对象的空腹外周静脉血,将血标本进行离心,离心采用医用离心机处理,离心半径为15 cm,离心的速度与时间分别为3 000 r/min及5 min,取离心后的血清部分进行血清β-淀粉样蛋白(Aβ1-40及Aβ1-42)、tau蛋白(tau及p-tau)及miR相关指标(miR-34a、miR-132及miR-135)的检测,其中β-淀粉样蛋白及tau蛋白采用酶联免疫法进行检测,miR相关指标则采用实时荧光定量PCR法进行检测。上述方面的检测均由两名经验丰富的检验科工作人员严格按照相关标准进行检测。然后与比较2组的上述血清β-淀粉样蛋白、tau蛋白及miR相关指标,并比较观察组不同严重程度血管性痴呆患者的上述检测结果,采用Spearman秩相关分析上述β-淀粉样蛋白、tau蛋白及miR相关指标与血管性痴呆严重程度的关系。
1.4 统计学方法 应用SPSS 23.0统计软件处理数据。计量资料采用t检验、单因素方差分析、SNK-q检验,各时点间的比较采用重复测量的方差分析;计数资料采用χ2检验。血清指标与疾病严重程度的关系采用Spearman秩相关分析处理。P<0.05为差异有统计学意义。
2 结 果
2.1 不同组间患者的血清β-淀粉样蛋白指标比较 观察组的血清Aβ1-42显著低于对照组,血清Aβ1-40显著高于对照组,差异有统计学意义(P<0.01);观察组不同严重程度血管性痴呆患者的上述检测结果比较,差异有统计学意义(P<0.05),见表1~2。
表1 2组血清β-淀粉样蛋白指标比较
Table 1 Comparison on the serum β-amyloid protein indexes of two groups![]()

组别Aβ1-40Aβ1-42观察组36.37±3.932.37±0.26对照组31.33±3.633.10±0.31t值8.37316.036P值<0.001<0.001
表2 不同严重程度患者的血清β-淀粉样蛋白指标比较
Table 2 Comparison on the serum β-amyloid protein indexes of patients with different severity![]()

*P值<0.01与轻度患者比较 #P值<0.01与中度患者比较(SNK-q检验)
严重程度例数Aβ1-40Aβ1-42轻度3933.23±3.702.93±0.30中度2535.56±3.91*2.50±0.27*#重度1537.63±4.09*#2.16±0.20*#F值7.81847.863P值<0.001<0.001
2.2 不同组间患者的血清tau 蛋白指标比较 观察组的血清tau蛋白(tau及p-tau)指标显著高于对照组,差异有统计学意义(P<0.001);观察组不同严重程度血管性痴呆患者的上述检测结果比较,差异有统计学意义(P<0.001),见表3~4。
表3 2组血清tau 蛋白指标比较
Table 3 Comparison of the serum tau protein indexes of two groups![]()

组别taup-tau观察组15.36±1.7313.31±1.59对照组12.21±1.3610.13±1.26t值12.72213.932P值<0.001<0.001
表4 不同严重程度患者的tau 蛋白指标比较
Table 4 Comparison of the serum tau protein indexes of patients with different severity![]()

*P值<0.01与轻度患者比较 #P值<0.01与中度患者比较(SNK-q检验)
严重程度例数taup-tau轻度3913.10±1.3911.01±1.31中度2515.19±1.67*13.07±1.50*重度1517.33±1.90*#14.96±1.63*#F值41.43544.913P值<0.001<0.001
2.3 不同组间患者的血清miR相关指标比较 观察组的血清miR-132及miR-135显著低于对照组,血清miR-34a显著高于对照组,差异有统计学意义(P<0.001),观察组不同严重程度血管性痴呆患者的上述检测结果比较,差异有统计学意义(P<0.001),见表5~6。
表5 2组血清miR相关指标比较
Table 5 Comparison on the serum miR-related indexes of two groups![]()

组别miR-34amiR-132miR-135观察组1.75±0.270.75±0.100.80±0.12对照组1.13±0.211.30±0.151.39±0.16t值16.11027.11626.220P值<0.001<0.001<0.001
表6 不同严重程度患者的血清miR相关指标比较
Table 6 Comparison of the serum miR-related indexes of patients with different severity![]()

*P值<0.01与轻度患者比较 #P值<0.01与中度患者比较(SNK-q检验)
严重程度例数miR-34amiR-132miR-135轻度391.31±0.250.96±0.121.10±0.15中度251.80±0.29*0.76±0.09*0.83±0.12*重度152.06±0.31*#0.60±0.06*#0.59±0.09*F值49.32875.56389.626P值<0.001<0.001<0.001
2.4 血清β-淀粉样蛋白、 tau 蛋白及miR相关指标与血管性痴呆严重程度的关系分析 Spearman秩相关分析显示,血清Aβ1-42、miR-132及miR-135与血管性痴呆严重程度呈负相关,血清Aβ1-40、tau 蛋白及miR-34a与血管性痴呆严重程度呈正相关(P<0.05),见表7。
表7 血清β-淀粉样蛋白、 tau 蛋白及miR相关指标与血管性痴呆严重程度的关系分析
Table 7 Analysis on the correlation between serum β-amyloid protein,tau protein,miR related indexes and different severity of vascular dementia
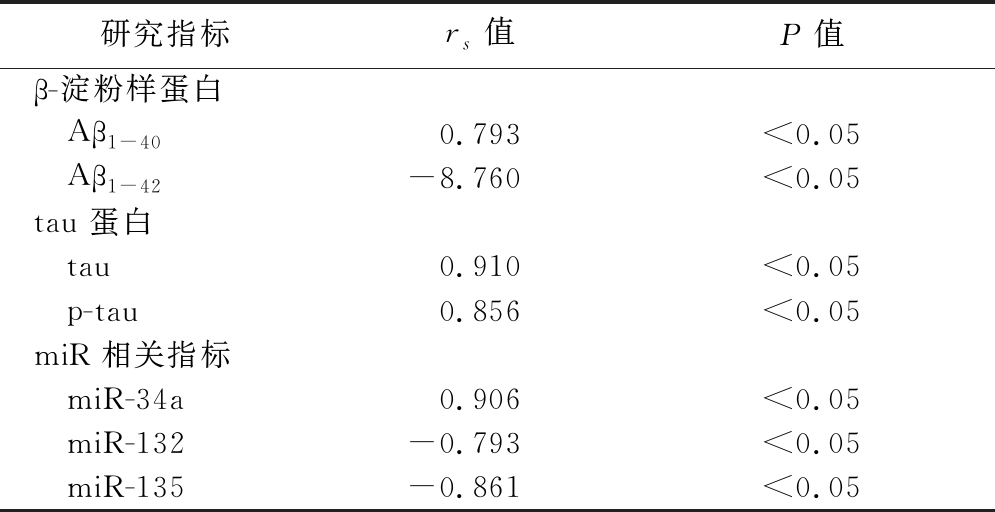
研究指标rs值P值β-淀粉样蛋白 Aβ1-400.793<0.05 Aβ1-42-8.760<0.05tau 蛋白 tau0.910<0.05 p-tau0.856<0.05miR相关指标 miR-34a0.906<0.05 miR-132-0.793<0.05 miR-135-0.861<0.05
3 讨 论
3.1 血管性痴呆相关血液指标的研究情况及不足 血管性痴呆在我国临床并不乏见,发病率约为1.1%~3.0%,其在65岁以上者占比相对较高,而本病对患者的危害显著,且对患者家庭及社会均造成较大负担。临床中与血管性痴呆相关的研究中,关于血液及脑脊液相关指标的研究一直是重点,在众多研究中占比也较高[6-7],而血液标本作为采集相对简便的方式,对其疾病相关指标的变化研究有助于疾病诊治措施的制定。β-淀粉样蛋白作为在认知障碍患者中研究较多的方面,其由细胞分泌,当细胞基质沉淀积聚后可对神经产生较强的毒性作用,而Aβ1-40及Aβ1-42作为在β-淀粉样蛋白中研究较多的指标,其在认知障碍患者中的研究相对较多[8-9],且研究多集中于阿尔茨海默病患者,在血管性痴呆患者中的研究相对不足。另外,tau 蛋白的过度磷酸化是胞浆tau蛋白异常,表现出神经元微管结构的受损,神经元受损,因此认为其在认知障碍患者中的检测价值较高[10-13],但是本类指标同样在血管性痴呆患者中表现异常的情况。再者,近年来关于认知障碍患者miR相关指标表达异常的研究不断增多,而miR-34a、miR-132及miR-135等作为在认知障碍及神经受损患者中表达显著异常的积累miR相关指标,其与神经突触的发育及可塑性等多方面有密切的关系,而异常的表达状态,可导致认知功能出现障碍[14],故其在血管性痴呆患者中的表达变化研究也有一定的临床需求。同时,上述指标与血管性痴呆研究程度的细致关系研究未见,因此本方面的全面细致研究极为必要。
3.2 血管性痴呆β-淀粉样蛋白、tau 蛋白及miR相关指标表达情况 本研究就β-淀粉样蛋白、tau 蛋白及miR相关指标在血管性痴呆患者中的变化及与严重程度的关系进行探究,结果显示,血管性痴呆患者的血清Aβ1-42、miR-132及miR-135显著低于健康者,血清Aβ1-40、tau 蛋白及miR-34a显著高于健康者,不同严重程度血管性痴呆患者的上述检测结果差异有统计学意义,Spearman秩相关分析肯定了上述指标与血管性痴呆严重程度的密切关系,因此肯定了β-淀粉样蛋白、tau 蛋白及miR相关指标在血管性痴呆患者中的检测意义及对疾病严重程度的反应价值。
3.3 血管性痴呆β-淀粉样蛋白、tau 蛋白及miR相关指标与疾病的关系分析 分析原因,Aβ1-40升高说明β-淀粉样蛋白升高,而Aβ1-42则可能与其沉积量增大有关,同时,认知受损严重,神经突触异常,均在较大程度上反应了tau 蛋白及miR相关指标异常的情况[15],且认知受损越为严重的患者,上述方面的异常程度越为严重[16],因此检测意义较高。Tau蛋白对于血管性痴呆的严重程度有一定的检测价值,而其早期的水平升高甚至有助于早期疾病的预测,这在一定程度上肯定了本研究的结果与方向。
综上所述,我们认为β-淀粉样蛋白、tau 蛋白及miR相关指标在血管性痴呆患者中呈现显著异常的状态,且与本病的严重程度密切相关,因此在血管性痴呆患者中的检测价值较高。
[1] 汪东良,王锦华,韩威威,等.血清学标志物Aβ1-42、sICAM-1、VILIP-1对脑梗死后血管性痴呆的预测价值[J].中华全科医学,2019,17(2):225-229.
[2] 毛蕾,付饶,马天君,等.早期血管性认知功能障碍生物标志物的研究进展[J].上海医药,2018,39(17):13-17.
[3] 江东东.高血压性脑白质损害大鼠认知功能减退及脑内β-淀粉样蛋白沉积的观察[D].南宁:广西医科大学,2018.
[4] 于建平,党小军. Aβ1-42、Tau和P-tau在AD与VD鉴别诊断中的应用价值[J].西南国防医药,2018,28(11):1099-1100.
[5] 王御林,高元杰,钟纯正,等.血管性痴呆患者血清miR-34a和VEGF的表达及临床意义[J]. 脑与神经疾病杂志,2020,38(3):155-158.
[6] 汪东良,王锦华,韩威威,等.血清学标志物Aβ1-42、sICAM-1、VILIP-1对脑梗死后血管性痴呆的预测价值[J].中华全科医学,2019,17(2):225-229.
[7] 董阳婷.氧化应激在β-淀粉样蛋白及氟化物引起的实验性中枢神经损伤病理过程中的作用及其分子机制[D].贵阳:贵州医科大学,2018.
[8] 张乐国,朱翠敏,吴强,等.β-淀粉样蛋白1-42与颈部动脉粥样硬化及轻度认知障碍的相关性研究[J].世界复合医学,2019,5(5):19-21.
[9] 李爱琳,蒋志宏,蔡鸣,等.遗忘型轻度认知障碍血液中Aβ42、P-Tau蛋白水平变化与海马区磁共振波分析相关性研究[J].影像研究与医学应用,2019,3(16):35-39.
[10] 杨莉,邹庆华,张艳,等.轻度认知功能障碍的类风湿关节炎患者血浆中S100B蛋白过度磷酸化tau蛋白β淀粉样蛋白的检测分析[J].中华风湿病学杂志,2018,22(10):649-653.
[11] 李薇薇,谢渭根.白细胞介素在血管性痴呆并糖耐量减低患者中的应用分析[J]. 重庆医学,2020,49(9):1492-1495.
[12] 刘莹莹,刘晶晶,王定淼.脑卒中后合并血管性认知功能障碍与血清Aβ1-42、HCY和Tau蛋白水平的关系[J].四川医学,2018,39(6):689-692.
[13] 李骏,朱常勤,梁金玲,等.糖尿病患者血液中tau磷酸化和总tau蛋白水平及PP2A活性与糖尿病后认知功能障碍研究[J].标记免疫分析与临床,2018,25(2):167-170.
[14] 刘湘玉,杨剑文.MicroRNAs与脑血管病研究最新进展[J].卒中与神经疾病,2018,25(1):92-93.
[15] 申潇竹,董燕,汪玲玲,等.老年低血糖患者血浆tau蛋白、ptau蛋白与认知功能关系的研究[J].中国糖尿病杂志,2018,26(7):559-562.
[16] Lin YF,Smith AV,Aspelund T,et al. Genetic overlap between vascular pathologies and Alzheimer′s dementia and potential causal mechanisms[J]. Alzheimers Dement,2019,15(1):65-75.