高血压是在我国发病率极高的一类疾病,其对心脑肾等多类靶器官的危害较大,严重危害到患者的健康状态乃至生命安全。临床中与高血压相关的研究中,关于高血压肾损伤的研究并不少见,而与之相关的研究涉及面较广,其中不乏肾脏血流变化及炎性损伤相关的研究[1-2],而炎症趋化因子作为有效趋化及介导炎症的重要指标,其在高血压患者中的表达变化研究可见[3-4],但是在肾损伤患者中的检测研究极为匮乏。再者,胰岛素抵抗在高血压患者中的检测日益受到重视,但是其与患者上述肾血流指标及炎症趋化因子的关系研究未见。因此,本研究就高血压肾损伤患者肾血流指标及炎症趋化因子与胰岛素抵抗的关系进行探究,现报告如下。
1 资料与方法
1.1 一般资料 选取2019年1月——2020年10月期间的高血压肾损伤患者80例为观察组,同时期的高血压无肾损伤患者80例为对照组。对照组男性43例,女性37例,年龄39~67岁,平均(50.9±6.6)岁,病程2.0~18.5年,平均(6.9±1.7)年;高血压分级:1~2级者57例,3级者23例;胰岛素抵抗指数(Homa-insulin resistance Homa-index,HOMA-IR)均在2.0以下。观察组男性41例,女性39例,年龄38~68岁,平均(51.3±6.3)岁,病程为1.8~19.2年,平均病程为(7.1±1.6)年;高血压分级:1~2级者58例,3级者22例;HOMA-IR:<2.0者38例,2.0~2.7者25例,>2.7者17例。2组的性别、年龄、病程、高血压分级和HOMA-IR比较差异无统计学意义(P>0.05),具有可比性。
本研究经医院伦理学委员会批准。
1.2 纳入标准及排除标准 纳入标准:20~75岁者;原发性高血压患者;对研究知情同意者。排除标准:合并原发性肾脏疾病者;合并其他泌尿系统疾病者;合并心脑肺肝等疾病者;妊娠期及哺乳期者;合并糖尿病者。
1.3 方法 采集2组患者的晨起空腹外周静脉血,采集量为4.0 mL,于采集的30 min内送检,采用医用离心机进行离心,将离心后的血清部分进行炎症趋化因子的检测,包括血清趋化因子配体2(chemokine ligand-2,CCL-2)、CXC类趋化因子配体10(chemokine CXCL-10,CXCL-10)及白细胞介素8(interleukin-8,IL-8),采用三项指标对应的酶联免疫法试剂盒进行定量检测;另于同日对两组患者采用彩色多普勒超声进行肾血流指标的检查,检查指标包括肾段动脉及肾叶间动脉收缩期峰值流速(peak velocity of the systolic wave,Vs)舒张期末流速(end diastolic peak flow velocity,Vd)、阻力指数(resistance index,RI)及搏动指数(pulsatility index,PI),均由经验丰富者进行操作检测。然后统计及比较2组的上述肾血流指标及炎症趋化因子水平,并比较观察组中不同HOMA-IR者的肾血流指标及炎症趋化因子水平,采用Spearman秩相关分析,肾血流指标及炎症趋化因子与胰岛素抵抗的关系。
1.4 统计学方法 应用SPSS23.0统计软件处理数据。计数资料比较采用χ2检验分析,计量资料采用t检验、单因素方差分析、SNK-q检验,研究项目间的关系进行Spearman秩相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 2组及观察组中不同HOMA-IR者的肾段动脉血流指标比较 观察组的肾段动脉Vs及Vd显著低于对照组,RI及PI及显著高于对照组,观察组中HOMA-IR较高者的肾段动脉Vs及Vd显著低于HOMA-IR较低者,RI及PI显著高于HOMA-IR较低者,差异有统计学意义(P<0.05),见表1,2。
表1 2组的肾段动脉血流指标比较
Table 1 Comparison of blood flow indexes of the segmental renal artery between two groups ![]()
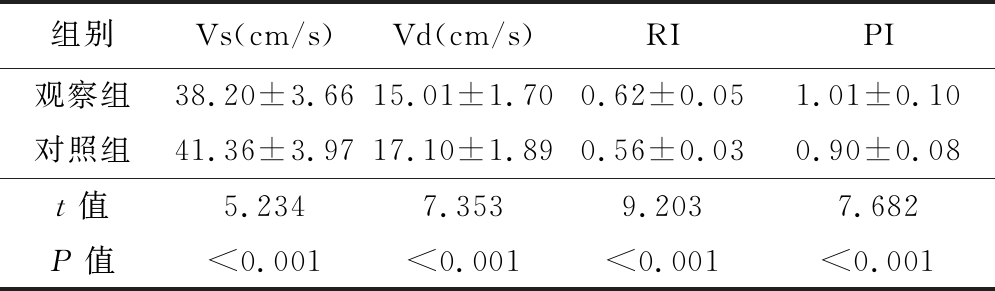
组别Vs(cm/s)Vd(cm/s)RIPI观察组38.20±3.6615.01±1.700.62±0.051.01±0.10对照组41.36±3.9717.10±1.890.56±0.030.90±0.08t值5.2347.3539.2037.682P值<0.001<0.001<0.001<0.001
2.2 2组及观察组中不同HOMA-IR者的肾叶间动脉血流指标比较 观察组的肾叶间动脉Vs及Vd显著低于对照组,RI及PI及显著高于对照组,观察组中HOMA-IR较高者的肾叶间动脉Vs及Vd显著低于HOMA-IR较低者,RI及PI显著高于HOMA-IR较低者,差异有统计学意义(P<0.05),见表3,4。
表2 观察组中不同HOMA-IR者的肾段动脉血流指标比较
Table 2 Comparison of blood flow indexes of the segmental renal artery in observation group with different insulin resistance indexes![]()

*P值<0.05与HOMA-IR<2.0组比较 #P值<0.05与HOMA-IR 2.0~2.7组比较(SNK-q检验)
HOMA-IR例数Vs(cm/s)Vd(cm/s)RIPI<2.0 3840.69±3.8616.86±1.830.58±0.040.92±0.092.0~2.72538.11±3.70*15.02±1.71*0.63±0.05*1.02±0.11#>2.7 1736.03±3.51*#13.11±1.56*#0.68±0.07*#1.16±0.13*#F值9.91628.60624.10530.782P值<0.001<0.001<0.001<0.001
表3 2组的肾叶间动脉血流指标比较
Table 3 Comparison of blood flow indexes of the interlobar renal artery between two groups ![]()

组别Vs(cm/s)Vd(cm/s)RIPI观察组26.76±2.3711.21±1.260.61±0.051.02±0.11对照组29.36±2.6313.11±1.370.55±0.030.88±0.07t值6.5689.1309.2039.603P值<0.001<0.001<0.001<0.001
表4 观察组中不同HOMA-IR者的肾叶间动脉血流指标比较
Table 4 Comparison of blood flow indexes of the interlobar renal artery in observation group with different insulin resistance indexes![]()
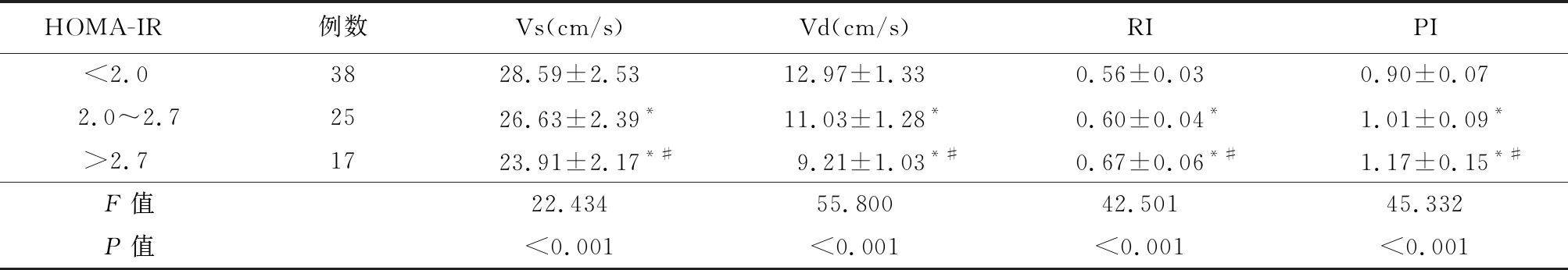
*P值<0.05与HOMA-IR<2.0组比较 #P值<0.05与HOMA-IR 2.0~2.7组比较(SNK-q检验)
HOMA-IR例数Vs(cm/s)Vd(cm/s)RIPI<2.0 3828.59±2.5312.97±1.330.56±0.030.90±0.072.0~2.72526.63±2.39*11.03±1.28*0.60±0.04*1.01±0.09*>2.7 1723.91±2.17*#9.21±1.03*#0.67±0.06*#1.17±0.15*#F值22.43455.80042.50145.332P值<0.001<0.001<0.001<0.001
2.3 2组及观察组中不同HOMA-IR者的炎症趋化因子比较 观察组的血清炎症趋化因子(CCL-2、CXCL-10及IL-8)显著高于对照组,观察组中HOMA-IR较高者的上述血清炎症趋化因子显著高于HOMA-IR较低者,差异有统计学意义(P<0.05),见表5,6。
表5 2组的炎症趋化因子比较
Table 5 Comparison of the inflammatory chemokines of two groups![]()
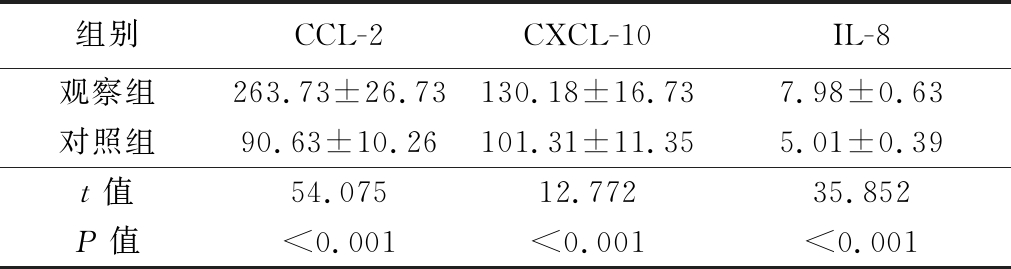
组别CCL-2CXCL-10IL-8观察组263.73±26.73130.18±16.737.98±0.63对照组90.63±10.26101.31±11.355.01±0.39t值54.07512.77235.852P值<0.001<0.001<0.001
2.4 肾血流指标及炎症趋化因子与胰岛素抵抗的关系分析 Spearman秩相关分析显示,肾段动脉及肾叶间动脉Vs及Vd与胰岛素抵抗呈负相关,肾段动脉及肾叶间动脉RI、PI及炎症趋化因子与胰岛素抵抗呈正相关(P<0.05),见表7。
表6 观察组中不同HOMA-IR者的炎症趋化因子比较
Table 6 Comparison of the inflammatory chemokines of observation group with different insulin resistance indexes![]()
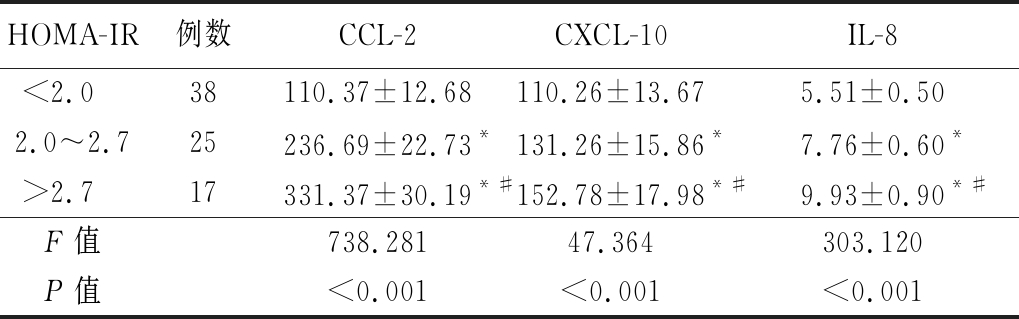
*P值<0.05与HOMA-IR<2.0组比较 #P值<0.05与HOMA-IR 2.0~2.7组比较(SNK-q检验)
HOMA-IR例数CCL-2CXCL-10IL-8<2.0 38110.37±12.68110.26±13.675.51±0.502.0~2.725236.69±22.73*131.26±15.86*7.76±0.60*>2.7 17331.37±30.19*#152.78±17.98*#9.93±0.90*#F值738.28147.364303.120P值<0.001<0.001<0.001
表7 肾血流指标及炎症趋化因子与胰岛素抵抗的关系分析
Table 7 Analysis of the relationship between renal blood flow indexes, inflammatory chemokines and insulin resistance
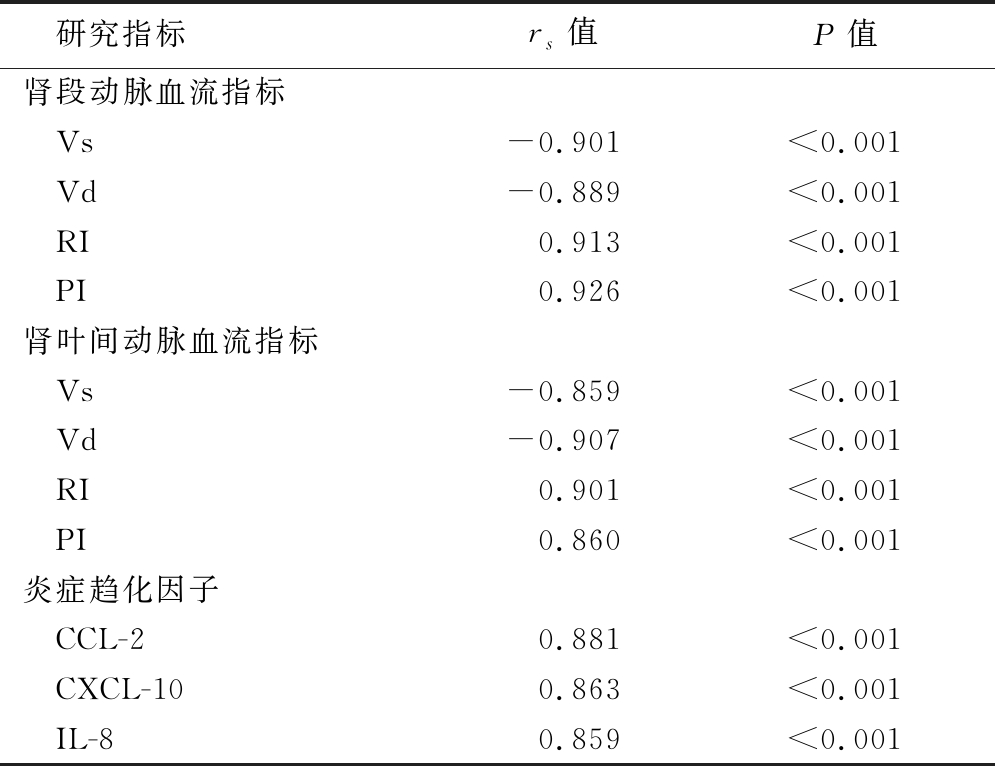
研究指标rs值P值肾段动脉血流指标 Vs-0.901<0.001 Vd-0.889<0.001 RI0.913<0.001 PI0.926<0.001肾叶间动脉血流指标 Vs-0.859<0.001 Vd-0.907<0.001 RI0.901<0.001 PI0.860<0.001炎症趋化因子 CCL-20.881<0.001 CXCL-100.863<0.001 IL-80.859<0.001
3 讨 论
3.1 高血压肾损伤危害 高血压在我国的发病率较高,且仍呈现快速大幅度升高的趋势,而与之相关的各方面损伤与危害是临床研究的重点,且受重视程度日益提升。高血压可对机体多系统器官造成损害,而心脑肾眼等作为高血压的靶器官,其相关的临床研究多见[5-6]。高血压肾损伤作为高血压常见并发症,其可导致患者的肾功能及结构受损,且较多损伤不可逆转,因此对高血压肾损伤的诊治重视程度极高。
3.2 高血压肾损伤的相关研究方面及研究不足 临床中与高血压肾损伤相关的研究涉及面较广,包括疾病发生发展过程中的相关指标变化规律等[7-8]。肾血流作为有效反应肾脏血供状态的指标,其在各类肾脏疾病及损伤中的变化研究可见,其中不乏高血压所致肾损伤中的研究,但是其研究差异仍较为显著。再者,炎症趋化因子中的CCL-2、CXCL-10及IL-8可有效反应炎性损伤的情况,在炎性细胞的定向趋化作用较强[9-11],其在高血压肾损伤患者中的变化研究虽可见,但是研究差异也普遍存在。再者,有研究显示,半数以上的高血压患者可能存在胰岛素抵抗[12-15],而此种情况的存在导致机体代谢的紊乱,其中脂代谢及其他方面的变化失衡情况突出[16-17],但是其与高血压患者肾血流指标及炎症趋化因子的关系研究未见。
3.3 高血压肾损伤患者肾血流指标及炎症趋化因子与胰岛素抵抗的关系分析 本研究就高血压肾损伤患者肾血流指标及炎症趋化因子与胰岛素抵抗的关系进行探究,结果显示,高血压肾损伤患者的肾段动脉及肾叶间动脉Vs及Vd显著低于无肾损伤的高血压患者,肾段动脉及肾叶间动脉RI、PI及炎症趋化因子显著高于无肾损伤的高血压患者,不同HOMA-IR高血压患者的肾血流指标及炎症趋化因子差异显著,Spearman秩相关分析显示,肾段动脉及肾叶间动脉Vs及Vd与胰岛素抵抗呈负相关,肾段动脉及肾叶间动脉RI、PI及炎症趋化因子与胰岛素抵抗呈正相关(P<0.05),因此较为细致地肯定了肾血流指标及炎症趋化因子与胰岛素抵抗的关系。分析原因,胰岛素抵抗的存在不仅影响到患者的交感神经状态,且可导致代偿性的代谢异常出现,而这均较大程度地影响到血管内皮功能状态[18-19],进而导致相关的肾脏血流指标变化,同时胰岛素抵抗作为公认的血管功能影响指标,其在血管紧张度的调节方面作用显著,因此也极大地影响到肾脏的各级血管及血流状态,而胰岛素抵抗越高者其变化失衡情况越为突出,同时局部损伤导致的炎症趋化作用表现也更为突出,局部血管内皮损伤情况更为严重[20-21],且高血压肾损伤患者的微炎性反应状态是诱导胰岛素抵抗的重要因素之一,因此进一步提升了上述指标间的关系。综上所述,我们认为高血压肾损伤患者的肾血流指标及炎症趋化因子显著异常,且与胰岛素抵抗有密切的关系,因此应重视对上述指标的检测与调控。
[1] 宋晓红,刘明明,王春晓,等.自发性高血压大鼠肾脏和胰腺微循环血流灌注和自律运动变化[J].微循环学杂志,2020,30(2):1-6.
[2] 江文科,揭英纯,程卓,等.非杓型高血压对肾动脉血流动力学影响的相关性研究[J].心肺血管病杂志,2020,39(8):933-935,941.
[3] 卢益中,季乃军,蓝翔,等.原发性高血压患者室间隔厚度、左室射血分数与肾动脉血流阻力指数的相关性研究[J/CD].中西医结合心血管病电子杂志,2020,8(3):70-71.
[4] 郭海龙.肾脏超声与肾脏生化检验指标诊断妊娠高血压患者肾功能受损情况的比较研究[J].中国药物与临床,2019,19(17):2956-2957.
[5] 黄艳华,夏月华,杨魏,等.高血压病人颈动脉内膜中层厚度、脉压、主动脉脉搏波传导速度与肾阻力指数的相关性分析[J].中西医结合心脑血管病杂志,2019,17(24):4043-4045.
[6] 钟思苗,丁辉,江泽良,等.肾血流超声检测预测高血压患者早期肾损伤的临床价值分析[J].内科,2019,14(2):165-167,132.
[7] 何小姣,许中恒.高血压患者认知功能障碍与Hcy、HIF-1α、CCL2水平的关系研究[J].标记免疫分析与临床,2020,27(2):271-274.
[8] 张国瑞,张静,王立君,等.高血压合并心绞痛患者颈动脉内膜中膜厚度与脂蛋白相关磷脂酶A2、炎性因子、T淋巴细胞及血管内皮功能的关系研究[J].实用心脑肺血管病杂志,2020,28(11):36-41.
[9] 张立芳,李博,周美宁.炎症因子基因多态性与原发性高血压患者发生脑卒中风险相关性[J].心脑血管病防治,2020,20(4):362-365.
[10] Krishnan SM,Ling YH,Huuskes BM,et al. Pharmacological inhibition of the NLRP3 inflammasome reduces blood pressure,renal damage,and dysfunction in salt-sensitive hypertension[J]. Cardiovasc Res,2019,115(4):776-787.
[11] 任英巧,李占增,伍淑玲,等.IL-8、IL-6、hs-CRP在缺血性脑血管病手术前后表达变化及临床价值[J].分子诊断与治疗杂志,2020,12(7):923-927.
[12] 王毓,张茜,张磊,等.血浆Cor NSE胰岛素抵抗与高血压性脑出血患者预后的关系[J].河北医学,2020,26(9):1409-1412.
[13] 齐晓贵,杜艳华,徐海波,等.高血压病人巨噬细胞移动抑制因子与胰岛素抵抗和肾功能指标的相关性[J].中西医结合心脑血管病杂志,2020,18(23):4054-4056.
[14] 朱雅琴,董文静,张伟伟.老年高血压患者颈动脉粥样硬化与血清脂联素、抵抗素水平的相关性[J].武警医学,2020,31(1):5-8.
[15] Bidani AK,Polichnowski AJ,Licea-Vargas H,et al. BP Fluctuations and the real-time dynamics of renal blood flow responses in conscious rats[J]. J Am Soc Nephrol,2020,31(2):324-336.
[16] Lu X,Crowley SD. Inflammation in salt-sensitive hypertension and renal damage[J]. Curr Hypertens Rep,2018,20(12):103.