糖尿病肾脏疾病(diabetic kidney disease DKD)是指糖尿病所致的慢性肾脏疾病,是糖尿病的主要微血管并发症之一,临床上以持续性白蛋白尿和(或)肾小球滤过率(estimate glomerular filtration rate,eGFR)进行性下降为主要特征。我国目前缺乏全国性的DKD流行病学资料,据统计成人2型糖尿病(type 2 dabetes mellitus,T2DM)患者DKD患病率为10%~40%[1]。DKD引起的终末期肾病占所有终末期肾病的16.4%[2]。因此DKD患者需要严格控制血糖同时延缓肾脏疾病进展。人胰高糖素样肽1(human glucagon-like peptide GLP-1)类似物利拉鲁肽,兼具降低血糖、控制体重、调节脂代谢紊乱、心血管获益等多重作用的降糖药物[3],同时发挥肾脏保护作用,带来潜在的肾脏获益[4]。尿白蛋白肌酐比值(urinary albumin creatinine ratio UACR)、估计eGFR、血、尿α1-微球蛋白(α1 microglobulin,α1-MG )、血、尿β2-微球蛋白(β2 microglobulin,β2-MG)是评估DKD的评估指标[1]。本研究观察利拉鲁肽治疗超重、肥胖T2DM并肾脏疾病患者的肾脏评估指标的变化,为探讨利拉鲁肽肾脏保护作用提供临床数据。
1 资料与方法
1.1 一般资料 选择2019年10月—2020年4月期间在河北省石家庄市人民医院住院及门诊随访的超重、肥胖DKD患者70例,符合WHO1999年世界卫生组织糖尿病专家委员会制定的糖尿病诊断标准;符合超重、肥胖判定标准,依据《中国成人肥胖症防治专家共识》(2011)标准,体重指数(body mass index,BMI)<24 为正常体重,BMI 24~28 为超重,BMI≥28为肥胖。将研究对象根据随机数字表随机分为利拉鲁肽组和胰岛素组,每组35例。入组前高血压患者给予血管紧张素转换酶抑制剂或血管紧张素受体拮抗剂在内的联合降压治疗方案,血压控制目标≤140/90 mmHg(1 mmHg=0.133 kPa),并给予糖尿病优质低蛋白饮食,每日活动量相对稳定,入组前均为口服降糖药控制血糖;入组后给予调整治疗方案:胰岛素组治疗方案为甘精胰岛素(赛诺菲)联合二甲双胍或(和)阿卡波糖,甘精胰岛素起始剂量按照 0. 3 U·kg-1·d-1起始[5];利拉鲁肽组治疗方案为利拉鲁肽(丹麦诺和诺德公司)联合二甲双胍或(和)阿卡波糖,利拉鲁肽起始剂量为0.6 mg 每日1次皮下注射,最大用到1.8 mg 每日1次皮下注射.;根据血糖情况调整药物剂量,血糖稳定后门诊随访,每12周随访1次。控制目标空腹血糖(fasting plasma glucose,FPG)<7.0 mmol/L,糖化血红蛋白(glycated hemoglobin,HbA1c)<7.0%,随访观察24周,随访结束时利拉鲁肽组退出4例,胰岛素组退出5例。利拉鲁肽组2例因胃肠道反应退出,1例失访,1例调整其他降糖方案退出。胰岛素组2例应用基础胰岛素治疗方案出现低血糖,停用胰岛素退出,2例换其他降糖方案退出,1例失访。胰岛素组30例,男性16例,女性14例,平均年龄(56.67±6.13)岁,病程(7.93±2.23)年;利拉鲁肽组31例,男性16例,女性15例,平均年龄(56.10±7.23)岁,病程(8.43±3.08)年。2组性别、年龄、病程差异无统计学意(P>0.05),具有可比性。
本研究经医院伦理委员会批准通过,研究对象均知情同意,签署知情同意书。
1.2 纳入标准和排除标准 纳入标准:①口服降糖药血糖控制不佳,入组前接受至少3个月的1种或以上口服降糖药治疗FPG≥7.0 mmol/L,7%≤HbA1c≤11%,UACR≥30 mg/g;②合并视网膜微血管病变。排除标准:①糖尿病急性并发症或合并严重慢性并发症患者;②泌尿道感染患者;③血肌酐升高或GFR下降过快;④尿蛋白迅速增加或出现肾病综合征;⑤顽固性高血压;⑥出现活动性尿沉渣;⑦给予血管紧张素转换抑制剂或血管紧张素受体拮抗剂治疗后2~3个月内eGFR下降大于30%;⑧eGFR<30 mL·min-1·1.73 m-2,或肾脏超声发现异常;⑨恶性肿瘤、甲状腺髓样癌家族史患者;⑩妊娠或哺乳期妇女。
1.3 观察指标 于入组前和研究结束后进行人体学测量,由专人测量身高、体重(body weight,WT)、收缩压、舒张压、腰围(waist circumference,WC)、计算BMI。检测血常规、尿常规、FPG、血脂七项,肝功能、肾功能(贝克曼AU5800全自动生化分析仪),HbA1c(层析法)、空腹胰岛素(fasting insulin,FINS)(电化学发光法,罗氏化学发光分析仪),计算稳态模型胰岛素抵抗指数(homeostasis model assessment for insulin resistance,HOMA-IR),HOMR-IR=FPG×FINS/22.5。入组前、治疗后12周、24周检测尿白蛋白(透色比浊法,罗氏Cobas8000)、尿肌酐(酶法,罗氏Co-bas8000),计算UACR及eGFR(使用CKD-EPI公式),检验血、尿α1-MG、β2-MG(免疫比浊法)。
1.4 统计学方法 应用SPSS 25.0软件进行数据分析。正态分布计量资料比较采用配对样本t检验或独立样本t检验,计量资料多个时点的比较采用重复测量的方差分析,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组治疗前后临床资料及生化指标的比较 胰岛素组治疗前、后WT、WC、BMI差异无统计学意义(P>0.05),FPG、HbA1c、FINS、HOMA-IR较治疗前明显降低(P<0.05)。利拉鲁肽组在治疗后FPG、HbA1c、FINS、HOMA-IR、WT、WC、BMI、均较治疗前明显降低(P<0.05);两组间比较利拉鲁肽组较胰岛素组治疗后WT、WC、BMI、HOMA-IR降低显著(P<0.05)。见表1。
表1 两组治疗前后临床资料、生化指标的比较
Table 1 Comparison of clinical data and biochemical between two groups data before and after treatment![]()
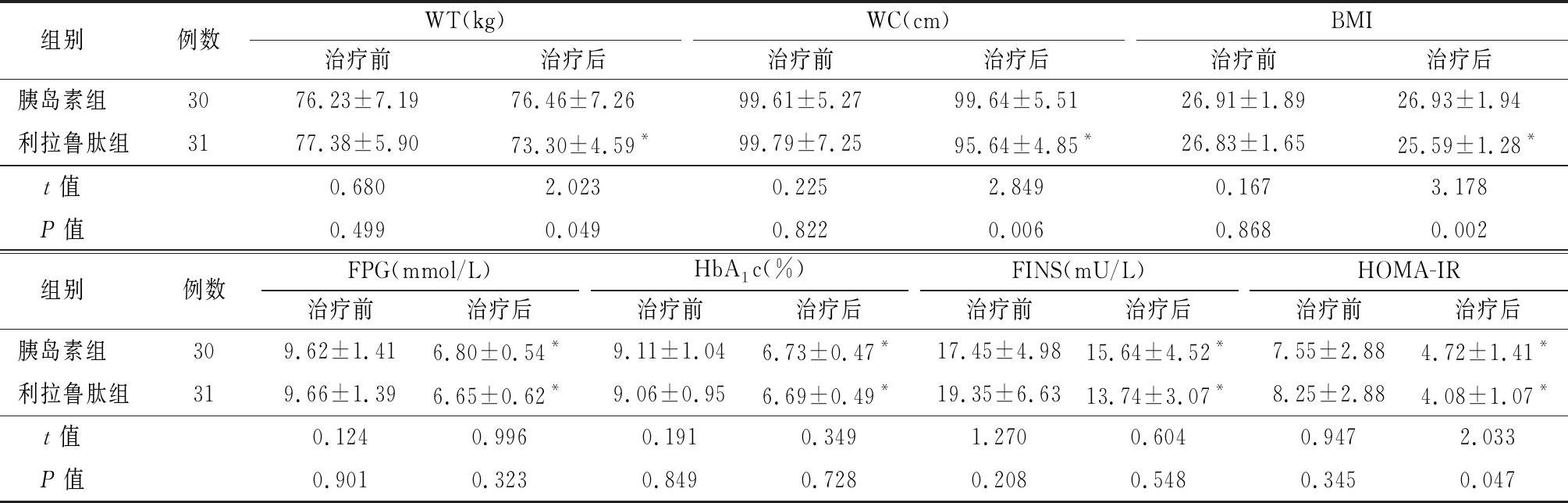
*P值<0.01与治疗前比较(配对t检验)
组别 例数WT(kg)治疗前治疗后WC(cm)治疗前治疗后BMI治疗前治疗后胰岛素组 3076.23±7.1976.46±7.2699.61±5.2799.64±5.5126.91±1.8926.93±1.94利拉鲁肽组3177.38±5.9073.30±4.59*99.79±7.2595.64±4.85*26.83±1.6525.59±1.28*t值 0.6802.0230.2252.8490.1673.178P值 0.4990.0490.8220.0060.8680.002组别 例数FPG(mmol/L)治疗前治疗后HbA1c(%)治疗前治疗后FINS(mU/L)治疗前治疗后HOMA-IR治疗前治疗后胰岛素组 309.62±1.416.80±0.54*9.11±1.046.73±0.47*17.45±4.9815.64±4.52*7.55±2.884.72±1.41*利拉鲁肽组319.66±1.396.65±0.62*9.06±0.956.69±0.49*19.35±6.6313.74±3.07*8.25±2.884.08±1.07*t值 0.1240.9960.1910.3491.2700.6040.9472.033P值 0.9010.3230.8490.7280.2080.5480.3450.047
2.2 两组治疗前后肾脏评估指标的比较 胰岛素组治疗后与治疗前比较,血α1-MG、尿α1-MG、血β2-MG、尿β2-MG均明显降低,差异有统计学意义(P<0.01);利拉鲁肽组治疗后与治疗前比较血α1-MG、尿α1-MG、血β2-MG、尿β2-MG均明显降低,差异有统计学意义(P<0.01);治疗24周后血α1-MG、尿α1-MG、尿β2-MG利拉鲁肽组与胰岛素组比较显著降低,差异有统计学意义(P<0.05)。两组UACR随着治疗的时间呈下降趋势,利拉鲁肽组较胰岛素组下降明显;eGFR呈升高趋势,利拉鲁肽组较胰岛素组升高显著,组间、时点间、组间·时点间交互作用差异有统计学意义(P<0.05)。见表2~4。
表2 两组治疗前后肾脏评估指标的比较
Table 2 Comparison of renal evaluation index between two groups before and after treatment![]()
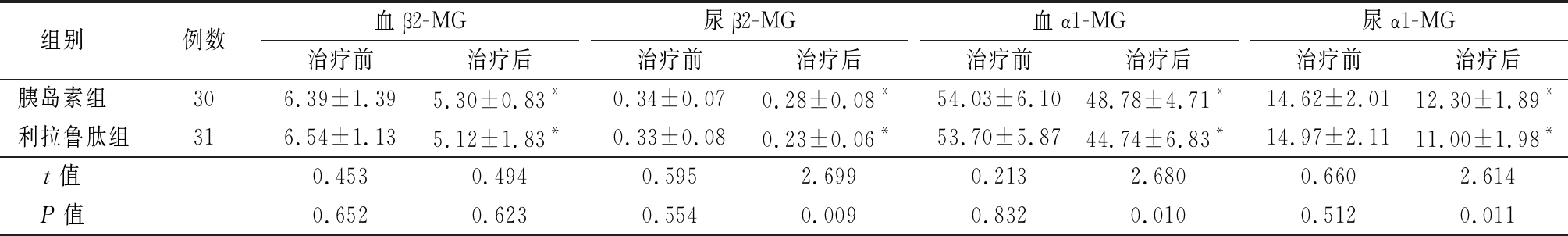
*P值<0.05与治疗前比较(配对t检验)
组别 例数血β2-MG治疗前治疗后尿β2-MG治疗前治疗后血α1-MG治疗前治疗后尿α1-MG治疗前治疗后胰岛素组 306.39±1.395.30±0.83*0.34±0.070.28±0.08*54.03±6.1048.78±4.71*14.62±2.0112.30±1.89*利拉鲁肽组316.54±1.135.12±1.83*0.33±0.080.23±0.06*53.70±5.8744.74±6.83*14.97±2.1111.00±1.98*t值 0.4530.4940.5952.6990.2132.6800.6602.614P值 0.6520.6230.5540.0090.8320.0100.5120.011
表3 两组治疗前后UACR变化的比较
Table 3 Comparison of urinary albumin creatinine ratio between two groups before and after treatment![]()

组别例数治疗前治疗12周治疗24周胰岛素组30297.82±64.39272.05±49.53241.14±57.47利拉鲁肽组31291.28±62.55249.08±51.67195.57±40.29组间F值=4.104 P值=0.047时间点F值=66.54 P值<0.001组间·时点间F值=4.426 P值=0.016
表4 两组治疗前后eGFR变化的比较
Table 4 Comparison of estimate glomerular filtration rate between two groups before and after treatment![]()
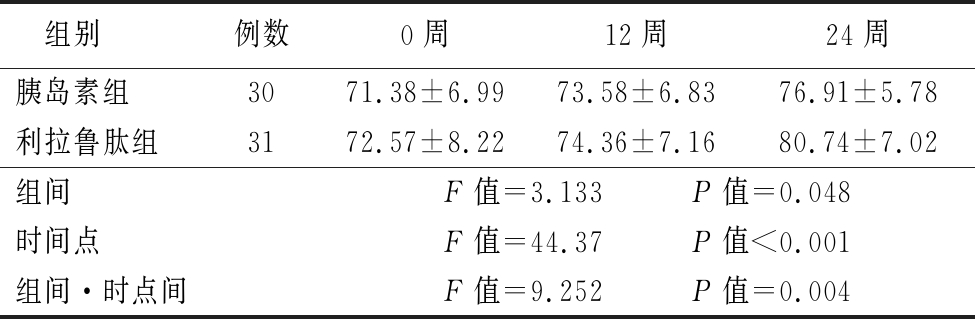
组别例数0周12周24周胰岛素组3071.38±6.9973.58±6.8376.91±5.78利拉鲁肽组3172.57±8.2274.36±7.1680.74±7.02组间F值=3.133 P值=0.048时间点F值=44.37 P值<0.001组间·时点间F值=9.252 P值=0.004
3 讨 论
DKD为慢性高血糖所致的肾脏损害,病变可以累及肾小球、肾小管、肾间质、肾血管等;年龄、病程、肥胖、高血糖、高血压、血脂异常等是糖尿病肾脏疾病发生、发展的高危因素。超重、肥胖的T2DM患者存在多种危险因素,是高风险人群。
DKD发病机制是多因素的,作用机制复杂,长期高血糖引起机体内晚期糖基化终末产物(advanced glycation end products,AGEs)堆积、氧化应激及蛋白激酶C( protein kinase C,PKC)通路激活,导致肾小球毛细血管内皮细胞的损伤;PKC通路激活还与细胞因子活化、细胞外基质增生、新生血管形成、血管通透性改变、肾小球基底膜糖化、电荷屏障消失等肾脏病理生理改变有关[6]。研究中两组患者治疗后FPG、HbA1c明显下降,胰岛素抵抗状态得到明显改善;治疗12周UACR出现下降,研究结束时UACR下降显著。在一项利拉鲁肽心血管结局研究中,观察了9 340例T2DM患者,随访3.84年,发现利拉鲁肽能够减少新发的持续大量蛋白尿的发生[7]。血糖控制达标可以有效的减少尿微量蛋白的排出,减轻肾脏损伤。GLP-1受体激动剂通过与人胰高糖素样肽1受体(human glucagon-like peptide receptor,GLP-1R)结合可纠正T2DM多重病理生理机制发挥降糖作用:GLP-1与胰腺β细胞中的GLP-1R结合,促进葡萄糖依赖的胰岛素分泌,降低血糖[8];参与及调控胰腺十二指肠同源框1基因的表达,促进胰岛β细胞增殖,减少凋亡[9];恢复胰岛β细胞对血糖的敏感性[10];减少肝糖输出,抑制食欲等。利拉鲁肽为GLP-1类似物,超重、肥胖T2DM患者经过治疗血糖达标,改善了糖尿病肾脏疾病的进展。本研究中观察到利拉鲁肽降低了超重、肥胖T2DM患者的WT、BMI、WC;减少UACR、改善eGFR方面优于胰岛素组,利拉鲁肽具有独立于降糖的肾脏保护作用,超重、肥胖可对包括肾脏在内的多个重要器官造成病理损害。体重达标有利于糖尿病肾脏疾病的好转,延缓糖尿病肾脏疾病进展。动物实验中观察到,肥胖相关肾病小鼠24 h尿微量白蛋白明显升高,肾脏病理表现为肾小球肥大,伴有局灶节段性硬化,系膜基质增多,给予利拉鲁肽治疗12周后,24 h尿微量白蛋白均明显减少,肾脏病理改变好转[6]。可能与利拉鲁肽诱导肥胖相关性肾病小鼠的自噬活性增加有关[11]。本研究中利拉鲁肽组eGFR明显升高,提示利拉鲁肽可能通过减轻肾脏负担、改善肾血动力学发挥肾脏保护作用,这一结果与 LEADER 研究中肾脏相关结果的显示也是一致的,Marina 等[12]对大鼠进行水或盐水负荷后,给予一种GLP-1R激动剂,肾小管近远端液体再吸收减少、离子和水的转运改变加速大鼠恢复水盐平衡的初始状态,这说明了GLP-1 参与选择性调节机体内水盐的平衡。GLP-1通过降低血糖、降低体重、改善肾血流,升高了eGFR。
DKD早期可以累及肾小管和肾间质,肾小管和肾间质病变与DKD预后密切相关。α1-MG是由肝细胞和淋巴细胞分泌的低分子糖蛋白,与血清免疫球蛋白A结合,游离状态的α1-MG能够通过肾小球滤过膜并在近端小管重吸收[13],肾小球滤过功能下降,α1-MG蓄积;血清α1-MG水平升高;肾小管损伤,尿α1-MG含量增加,尿α1-MG为肾小管的评估指标,在糖尿病肾病预后评估中具有一定价值[14]。β2-MG相对分子质量小且不和血浆蛋白结合,可滤入原尿,原尿中99%的β2-MG被近端肾小管胞饮并降解。血β2-MG反应肾小球滤过功能,血清β2-MG 检测能够帮助临床早期确诊,同时还能对患者的病情进行有效评估[15]。尿β2-MG是反应肾小管重吸收功能的指标。本研究结束时观察到利拉鲁肽组与胰岛素组均降低了尿α1-MG、β2-MG,血α1-MG、β2-MG,利拉鲁肽组尿α1-MG、β2-MG,血α1-MG降低更加明显。肾小管上皮细胞也表达AGEs受体,AGEs增多激活PKC通路,通过增加氧化应激反应等途径导致肾小管重吸收功能降低和肾间质纤维化[16]。糖尿病肾病小鼠给予利拉鲁肽腹腔注射,减少了肾脏组织的脂质沉积、减少肾小管区域的空泡和改善增大的肾小球囊腔[17]。利拉鲁肽降糖同时改善了肾小管的功能,在高糖状态下发挥肾脏保护作用,部分是由于抑制自噬及增加GLP-1R的表达,体外实验[18]中,肾小管上皮细胞暴露于高糖浓度下导致GLP-1R表达下调,利拉鲁肽能够抑制GLP-1R表达下调且能抑制细胞凋亡。
UKPD研究显示,强化血糖控制可以有效的预防新诊断T2DM患者微量蛋白尿发生,DCCT研究证明,HbA1c的持续改善减少了DKD的发生风险。因此,良好的血糖控制对防止DKD发生发挥展非常重要的作用,利拉鲁肽能多方面发挥降糖作用、可以降低超重、肥胖T2DM患者体重,降低尿微量白蛋白,降低血、尿微球蛋白发挥独立于降糖之外的肾脏保护作用。本研究项目观察时间较短,需进一步随访观察利拉鲁肽对于肾脏终点事件的影响,获得更多的临床数据。
[1] 中华医学会糖尿病学分会微血管并发症学组.中国糖尿病肾脏疾病防治临床指南[J].中华糖尿病杂志,2019,11(1):15-28.
[2] 中华医学会内分泌学分会.中国成人糖尿病肾脏病临床诊断的专家共识[J].中华内分泌代谢杂志,2015,31(1):379-385.
[3] Marso SP,Daniels GH,Brown-Frandsen K,et al. Liraglutide and cardiovascular outcomes in type 2 diabetes[J]. N Engl J Med,2016,375(4): 311-322.
[4] Sloan LA. Review of glucagon-like peptide-1 receptor agonists for the treatment of type 2 diabetes mellitus in patients with chronic kidney disease and their renal effects[J]. J Diabetes,2019,11(12): 938-948.
[5] Ji L,Wan H,Wen B,et al. Higher versus standard starting dose of insulin glargine 100 U/mL in overweight or obese Chinese patients with type 2 diabetes:results of a multicentre,open label,randomized controlled trial (BEYOND VII)[J]. Diabetes Obes Metab,2020,22(5):838-846.
[6] Gamal H,Shankar MU. Aldose reductase as a drug target for treatment of diabetic nephropathy promises and challenges[J]. Protein Pept Lett,2017,24(1):71-77.
[7] Mann JFE,Ørsted DD,Brown-Frandsen K,et al. Liraglutide and renal outcomes in type 2 diabetes[J]. N Engl J Med,2017,377(9):839-848.
[8] Jorsal T,Rhee NA,Pedersen J,et al. Enteroendocrine K and L cells in healthy and type 2 diabetic individuals[J]. Diabetologia,2018,61(2):284-294.
[9] 郑坤杰,武革,耿建林,等.不同降糖药物对2型糖尿病大鼠胰岛β细胞凋亡及再生作用的影响[J].河北医科大学学报,2017,38(11):1260-1264.
[10] Anholm C,Kumarathurai P,Pedersen LR,et al. Liraglutideeffects onbeta-cell,insulinsensitivityand glucose effectiveness in patients with stable coronary artery disease and newly diagnosed type 2 diabetes[J]. Diabetes Obes Metab,2017,19(6):850-857.
[11] 李娜,郭晶晶,霍琴琴,等.利拉鲁肽对肥胖相关性肾病的作用以及与自噬通路的关系[J].安徽医科大学学报,2018,53(7):1032-1036.
[12] Marina AS,Kutina AV,Shakhmatoba EI,et al. Involvement of glucagon-like peptide-1 in the regulation of selective excretion of sodium or chloride ions by the kidneys[J]. Bull Exp Biol Med,2017,162(4):436-440.
[13] 范瑾.血清及尿液特定蛋白检测在糖尿病肾病早期诊断中的意义[J].检验医学与临床,2017,14(5):689-690.
[14] 覃静.血清 Cys-C、CRP 及尿 α1 微球蛋白在糖尿病肾病患者预后评估中的应用价值[J].中国卫生工程学,2020,19(6):906-907.
[15] 王金霞.血清胱抑素C和β2微球蛋白检测在2型糖尿病肾病早期诊断中的价值[J].现代诊断与治疗,2018,29(18):2959-2961.
[16] Sutariya B,Tanejab N,Badgujara L,et al. Modulatory effect of betanin on high glucose induced epithelial to mesenchymal transition in renal proximal tubular cells[J]. Biomed Pharmacother,2017,89:18-28.
[17] 梁日英,符畅,梁华,等.利拉鲁肽抑制 ERS 改善高脂饮食诱导的糖尿病肾病肾损害[J].新医学,2019,50(11):826-831.
[18] Yang S,Lin C,Zhuo X,et al. Glucagon-like peptide-1 alleviates diabetic kidney disease through activation of autophagy by regulating AMP-activated protein kinase-mammalian target of rapamycin pathway[J]. Am J Physiol Endocrinol Metab,2020,319(6):1019-1030.