国内外研究证实,代谢综合征、慢性肾脏病或2型糖尿病(diabetes mellitus,DM)患者逐年增加,导致患者生活质量和预期寿命均明显下降[1-2],通过卫生管理方法,采取相应措施可降低患者的患病率并改善其生活质量。其中,高尿酸血症作为一个近年来主要的公共卫生健康问题,在国内外受到越来越多的临床关注,且其与代谢综合征、高血压、肾脏和心血管疾病密切相关[3]。虽然高尿酸血症是否是肾脏疾病的病因仍有争议,但肾脏在调节血清尿酸水平方面起着重要作用,高尿酸血症已被证实可以预测肾脏疾病的发生和进展[4],且在代谢相关疾病中也起着重要作用,如代谢综合征、DM和非酒精性脂肪肝[5-6]。研究显示,全球DM患病率已达到流行比例,预计到2045年将从2017年的451万增加到估计的693万[7]。其中微血管并发症是其死亡的主要原因,而糖尿病肾病(diabetic nephropathy,DN)是其最为重要的微血管并发症之一,发生在20%~40%的DM患者[8]。DN是发达国家终末期肾病(end stage renal diseas,ESRD)的主要病因。在我国DN患病率每年都呈上升趋势[9],因此,研究DN高尿酸血症的危险因素具有重要临床意义,本研究旨在研究2型DN高尿酸血症的危险因素,为合并高尿酸血症的DN的防治提供理论依据。
1 资料与方法
1.1 一般资料 选取2016年2月—2019年8月在河北省保定市第一中心医院住院的临床资料齐全、来自保定地区的2型DN患者350例,根据男性和绝经后女性血尿酸(uric acid,UA)≥420 μmol/L、绝经前女性血UA≥360 μmol/L为高尿酸血症,将其分为正常尿酸(对照组)200例及高尿酸血症(观察组)150例。DM均符合1999年世界卫生组织(World Health Organization,WHO)提出的DM诊断标准,DN诊断标准符合有较长期的DM病史,临床上出现蛋白尿、DM眼底改变。排除标准:①DM酮症酸中毒,高渗非酮症昏迷,DN大量蛋白尿,泌尿系感染,心、肝、肾功能不全,风湿性疾病等系统性疾病;②妊娠、哺乳期妇女或拟妊娠的育龄期妇女;③有肾动脉狭窄;④有肾移植病史;⑤肝硬化失代偿阶段,或有肝性脑病的病史;⑥在过去的5年内有任何系统的恶性肿瘤疾病史;⑦任何现存的威胁生命的状况,预计存活时间为2年以内;⑧在过去的12个月内有药物或乙醇滥用的病史或证据。
1.2 方法 收集所有患者的资料,包括性别、年龄、体重指数(body mass index,BMI)、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)。另外,使用自动生化分析仪检测白细胞(white blood cell,WBC)、血小板(platelet,PLT) 、血红蛋白(hemoglobin,Hb)、糖化血红蛋白A1c(hemoglobin A1c,HbA1c)、白蛋白(albumin,ALB)、低密度脂蛋白胆固醇(Low density lipoprotein-cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)、血尿素氮(blood urea nitrogen,BUN)、C反应蛋白(C-reactive protein,CRP)、24 h尿蛋白(24 hours urinary protein,24 hUpro)、血清肌酐(serum creatinine,SCr)的水平。
1.3 统计学方法 应用SPSS 17.0统计软件分析数据。计量资料比较采用独立样本t检验;计数资料比较采用χ2检验;等级变量比较采用秩和检验;多因素分析采用二元Logistic回归分析。P<0.05为差异有统计学意义。
2 结 果
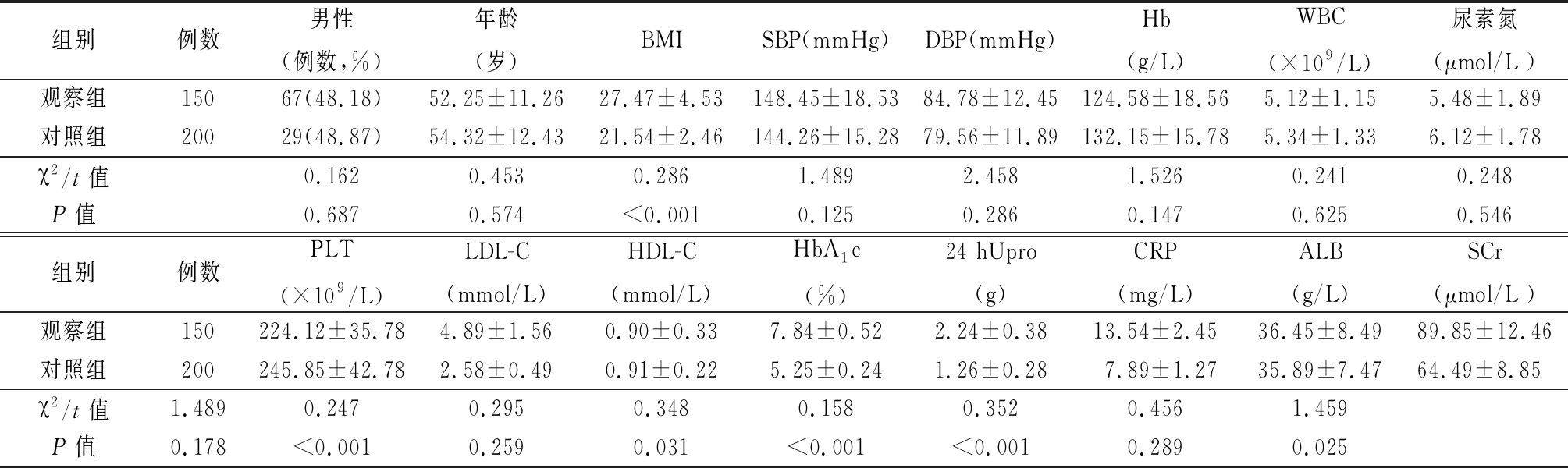
2.1 两组一般资料比较 观察组BMI、LDL-C、HbA1c、24 hUpro、CRP、SCr高于对照组,差异有统计学意义(P<0.05)。两组性别、年龄、SBP、DBP、Hb、WBC、PLT、ALB、BUN比较差异无统计学意义(P>0.05)。见表1。
表1 两组一般资料比较
Table 1 Comparison of general data between two groups![]()
1 mmHg=0.133 kPa
组别例数男性(例数,%)年龄(岁)BMISBP(mmHg)DBP(mmHg)Hb(g/L)WBC(×109/L)尿素氮(μmol/L )观察组15067(48.18)52.25±11.2627.47±4.53148.45±18.5384.78±12.45124.58±18.565.12±1.155.48±1.89对照组20029(48.87)54.32±12.4321.54±2.46144.26±15.2879.56±11.89132.15±15.785.34±1.336.12±1.78χ2/t值0.1620.4530.2861.4892.4581.5260.2410.248P值0.6870.574<0.0010.1250.2860.1470.6250.546组别例数PLT(×109/L)LDL-C(mmol/L)HDL-C(mmol/L)HbA1c(%)24 hUpro(g)CRP(mg/L)ALB(g/L)SCr(μmol/L )观察组150224.12±35.784.89±1.560.90±0.337.84±0.522.24±0.3813.54±2.4536.45±8.4989.85±12.46对照组200245.85±42.782.58±0.490.91±0.225.25±0.241.26±0.287.89±1.2735.89±7.4764.49±8.85χ2/t值1.4890.2470.2950.3480.1580.3520.4561.459P值0.178<0.0010.2590.031<0.001<0.0010.2890.025
2.2 多因素分析结果 对于上述有统计学差异的变量进行采用二元Logistic回归分析,以血尿酸是否增高为因变量,以血尿酸(正常=0,增高=1)、BMI(正常=0,增高=1)、LDL-C(正常=0,增高=1)、HbA1c(正常=0,增高=1)、24 hUpro(正常=0,增高=1)、CRP(正常=0,增高=1)、SCr(正常=0,增高=1)为自变量,以后退法纳入回归方程,以P<0.05,差异有统计学意义。回归分析结果显示,BMI、CRP、LDL-C、24 hUpro是DN的高尿酸血症独立相关因素(P<0.05),见表2。进一步绘制ROC曲线,并根据曲线坐标复制于EXCEL表中进一步计算,LDL最佳截点数值为4.86 mmol/L,BMI最佳截点数值为27.72,24 hUpro最佳截点数值为2.29 g,CRP最佳截点数值为14.12 mmol/L,见图1。
表2 多因素分析结果
Table 2 Results of multivariate analysis
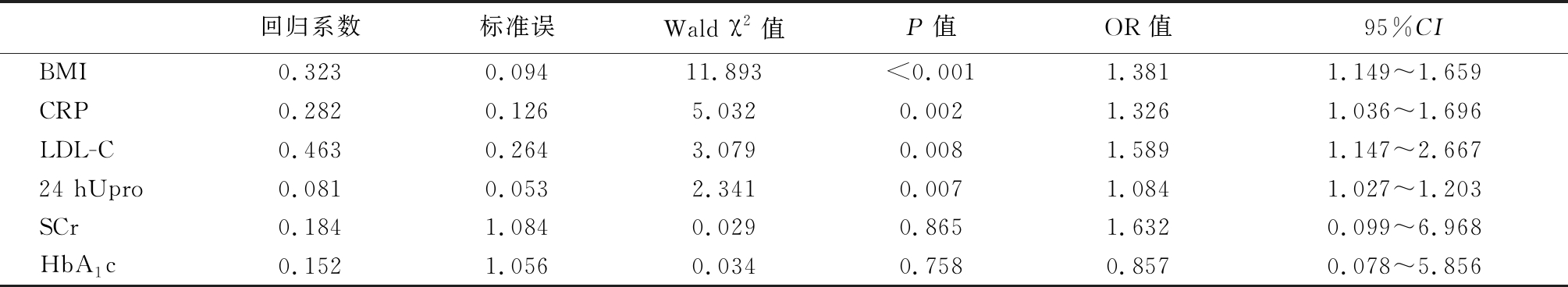
回归系数标准误Wald χ2值P值OR值95%CIBMI0.3230.09411.893<0.0011.3811.149~1.659CRP0.2820.1265.0320.0021.3261.036~1.696LDL-C0.4630.2643.0790.0081.5891.147~2.66724 hUpro0.0810.0532.3410.0071.0841.027~1.203SCr0.1841.0840.0290.8651.6320.099~6.968HbA1c0.1521.0560.0340.7580.8570.078~5.856
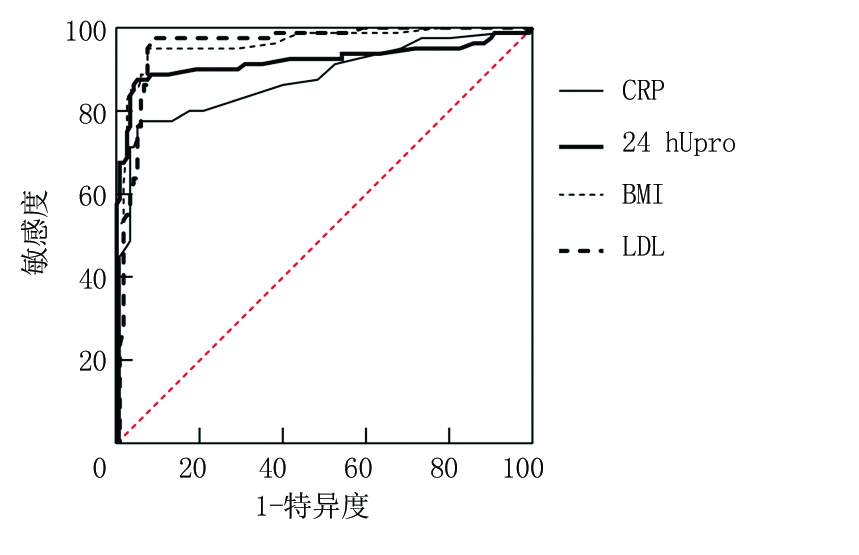
图1 CRP、24 hUpro、BMI、LDL的ROC曲线图
Figure 1 ROC curve of CRP, 24 hUpro, BMI and LDL
3 讨 论
DM是世界大部分地区终末期肾病的主要原因[10],DN是一种不可逆的进展性慢性肾脏疾病,其病因非常复杂,发病机制可归因于系膜细胞凋亡、炎性细胞因子、肾小球高压和高滤过等,影响肾功能,可改变通常排出体内废物和多余液体的过程。DN患者肾脏疾病的体征和症状包括蛋白尿、体重增加、肢体水肿、夜间尿频、晨吐、贫血和高血压,约40%的2型DM患者和30%的1型DM患者发生DN。DN是慢性肾脏病和终末期肾病的主要原因,也与高病死率有关,且随着疾病的严重程度而增加,甚至在早期DKD患者中死亡风险也较高。血尿酸升高是机体嘌呤代谢紊乱导致尿酸产生过多或清除减少的结果,随着生活方式的改变,高尿酸血症目前已成为全世界常见的危害公共健康的代谢性疾病。尿酸是嘌呤代谢的最终酶促产物,具有清除氧自由基和保护红细胞膜免受脂质氧化的能力。然而,血清尿酸升高(高尿酸血症)与痛风、心血管疾病、慢性肾脏疾病和2型DM的风险显著增加有关。国外研究证实,高尿酸血症与DN呈正相关,高尿酸血症在2型DM中对DN的病理改变有明显加重作用[11-14]。研究显示,高尿酸血症是2型DM和DN的潜在危险因素[15]。本研究结果显示,在DN高尿酸血症患者中,患者BMI、LDL-C、HbA1c、24 hUpro、CRP、SCr较高(P<0.05)。对以上检测项目进一步行二元Logistic回归分析,多因素分析结果显示,BMI、CRP、LDL-C、24 hUpro与是DN的高尿酸血症独立相关因素。
研究证实,肥胖不仅与心血管疾病、DM、中风发病密切相关,还与代谢综合征关系密切,易引起高尿酸血症[16]。纳入27 944例痛风病例和215 739例参与人员的研究显示,BMI增加 5,其痛风风险增加55%[17]。高尿酸血症和肥胖是众所周知的DM危险因素,且肥胖与高尿酸血症呈正相关。内脏脂肪积累的增加会导致游离脂肪酸向肝脏和内脏脂肪组织溢出,从而诱导过量的尿酸生成。此外,磷酸戊糖途径提供了过量的游离脂肪酸,这可能与从头合成嘌呤有关,且反作用加速尿酸的合成。研究表明,内脏脂肪组织在病理上是活跃的,脂肪细胞失调可改变尿酸在肾小管中的运输,从而减少尿液排泄和尿钠排泄,导致高尿酸血症。本研究结果显示,BMI是DN患者高尿酸血症的独立危险因素,可能与肥胖患者体外摄入过多能量导致嘌呤生产过多有关,也可能与脂肪过多抑制尿酸排泄有关。肥胖患者往往合并高脂血症,DN高尿酸血症患者多数有脂质代谢紊乱,表现为高脂血症,本研究显示DN高尿酸血症与LDL-C增高正相关,与Yang等[18]研究一致。Fu等[19]研究也显示,2型DM患者的高尿酸血症,与CRP、尿蛋白增高密切相关。虽然高尿酸血症和肥胖之间的联系已经在以前的研究中得到了证明,但它们之间的时间关系,以及这种时间关系是否与未来的DM风险相关,仍然在很大程度上是未知的。因此,有必要弄清它们之间的时间关系,以提供潜在的2型DM预防策略。根据病理生理和代谢研究,高尿酸血症和肥胖可能相互影响,通过多种病理生理机制,高尿酸血症可通过加速肝脏和外周脂肪生成而导致肥胖。
DN高尿酸血症的发病机制非常复杂,但肾脏疾病因素起重要作用,可能与肾脏排泄尿酸的功能受损,嘌呤分解代谢增强和尿酸生成增加等相关。DN易合并高尿酸血症,还常伴随肥胖、高血压、高脂血症,从而影响尿酸、血糖及胰岛素的代谢。DN高尿酸血症患者往往存在明显的高胰岛素血症和胰岛素抵抗,而胰岛素抵抗有助于解释肥胖、血脂异常及高血糖症等的发生,高胰岛素血症可以导致近端肾小管对钠的重吸收增加,产生高尿酸血症[20]。目前普遍认为,高胰岛素血症是这些疾病共同的病理生理基础,改善胰岛素抵抗,对减少DM、高尿酸血症患者心脑血管事件的病死率具有重要临床意义。
本研究存在一些不足,首先,通过单中心回顾性研究分析入院2型DM患者高尿酸血症的危险因素,但受区域限制导致样本量有限。其次,本研究设计未纳入治疗药物及日常饮食对血尿酸的影响因素,研究的暴露变量与结果变量并存,且难以完全控制混杂因素的影响,无法判断暴露与结果之间的时间序列,不能得到两者间明确的因果关系。因此,本研究DN高尿酸血症的危险因素分析可能具有一些特殊的特点,需要结合实际情况分析,还需进一步大规模前瞻性研究中予以确认和补充。
本研究针对入院2型DM患者,采用系统的方法对DN高尿酸血症的危险因素进行分析,其独立危险因素包括BMI、CRP、LDL-C、24 hUpro。本研究为预防和延缓DN的发生发展提供理论和临床依据。对于DN高尿酸血症患者,应特别关注影响DN发生和发展的危险因素,应积极采取早期诊断和早期治疗措施,可有望延长DN患者的生存期[21-22]。
[1] Maloberti A,Giannattasio C,Bombelli M,et al. Working Group on Uric Acid and Cardiovascular Risk of the Italian Society of Hypertension(SIIA). Hyperuricemia and risk of cardiovascular outcomes:the experience of the URRAH(Uric Acid Right for Heart Health) Project[J]. High Blood Press Cardiovasc Prev,2020,27(2):121-128.
[2] Li L,Zhang Y,Zeng C. Update on the epidemiology,genetics,and therapeutic options of hyperuricemia[J]. Am J Transl Res,2020,12(7):3167-3181.
[3] Wu X,Jian G,Tang Y,et al. Asymptomatic hyperuricemia and incident congestive heart failure in elderly patients without comorbidities[J]. Nutr Metab Cardiovasc Dis,2020,30(4):666-673.
[4] Li GX,Jiao XH,Cheng XB. Correlations between blood uric acid and the incidence and progression of type 2 diabetes nephropathy[J]. Eur Rev Med Pharmacol Sci,2018,22(2):506-511.
[5] King C,Lanaspa MA,Jensen T,et al. Uric Acid as a Cause of the Metabolic Syndrome. Contrib Nephrol[J]. 2018,192(1):88-102.
[6] Ma Z,Zhang J,Kang X,et al. Hyperuricemia precedes non-alcoholic fatty liver disease with abdominal obesity moderating this unidirectional relationship:Three longitudinal analyses[J]. Atherosclerosis,2020,311(10):44-51.
[7] Cho N,Shaw J,Karuranga S,et al. IDF diabetes atlas:global estimates of diabetes prevalence for 2017 and projections for 2045[J]. Diab Res Clin Pract,2018,138(3):271-281.
[8] American Diabetes Association. Microvascular complications and foot care:standards of medical care in diabetes-2019[J]. Diabetes Care,2019,42(1):124-138.
[9] Chen Y,Lee K,Ni Z,et al. Diabetic kidney disease:challenges,advances,and opportunities[J]. Kidney Dis(Basel),2020,6(4):215-225.
[10] Lin YC,Chang YH,Yang SY,et al. Update of pathophysiology and management of diabetic kidney disease[J]. J Formos Med Assoc,2018,117(8):662-675.
[11] Ansari V,Zargari M,Makhlough A,et al. Association of uric acid with antioxidant capacity of plasma in patients with type 2 diabetic nephropathy[J]. Res Mol Med,2015, 3(4):23-27.
[12] Bjornstad P,Laffel L,Lynch J,et al. Elevated serum uric acid Is associated with greater risk for hypertension and diabetic Kidney diseases in obese adolescents with type 2 diabetes:an observational analysis from the treatment options for type 2 diabetes in adolescents and Y=youth(TODAY) study[J]. Diabetes Care,2019,42(6):1120-1128.
[13] Behradmanesh S,Horestani MK,Baradaran A,et al. Association of serum uric acid with proteinuria in type 2 diabetic patients[J]. J Res Med Sci, 2013,18(1):44-46.
[14] Zoppini G,Targher G,Chonchol M,et al.Serum uric acid levels and incident chronic kidney disease in patients with type 2 diabetes and preserved kidney function[J]. Diabetes Care,2012,35(1):99-104.
[15] Shah P,Bjornstad P,Johnson RJ. Hyperuricemia as a potential risk factor for type 2 diabetes and diabetic nephropathy[J]. J Bras De Nefrol,2016,38(4):386-387.
[16] Thottam GE,Krasnokutsky S,Pillinger MH.Gout and metabolic syndrome:a tangled web[J]. Curr Rheumatol Rep,2017,19(10):60.
[17] Aune D,Norat T,Vatten LJ. Body mass index and the risk of gout:a systematic review and dose-response meta-analysis of prospective studies[J]. Eur J Nutr,2014,53(8):1591-1601.
[18] Yang WX,Ma Y,Hou YL,et al. Prevalence of hyperuricemia and its correlation with serum lipids and blood glucose in physical examination population in 2015-2018:A retrospective study[J]. Clin Lab,2019,65(8):1501-1506.
[19] Fu CC,Wu DA,Wang JH,et al. Association of C-reactive protein and hyperuricemia with diabetic nephropathy in Chinese type 2 diabetic patients[J]. Acta Diabetol,2010,46(2):127-134.
[20] Liu XZ,Xu X,Zhu JQ,et al. Association between three non-insulin-based indexes of insulin resistance and hyperuricemia[J]. Clin Rheumatol,2019,38(11):3227-3233.
[21] Pugliese G,Penno G,Natali A,et al. Diabetic kidney disease:new clinical and therapeutic issues. Joint position statement of the Italian Diabetes Society and the Italian Society of Nephrology on “The natural history of diabetic kidney disease and treatment of hyperglycemia in patients with type 2 diabetes and impaired renal function”[J]. Nutr Metab Cardiovasc Dis,2019,29(11):1127-1150.
[22] Hu F,Zhang T. Study on risk factors of diabetic nephropathy in obese patients with type 2 diabetes mellitus[J]. Int J Gen Med,2020,13(5):351-360.