血管瘤在婴幼儿良性肿瘤中比较常见,其发病率为10%~12%,男女比例为1∶3~1∶5[1],在早产儿中,其发病率更高。婴儿血管瘤虽有自限性,但部分瘤体生长较快,甚至有发生出血和破溃的危险,进而导致瘤体区域感染和功能障碍。因此,强烈呼吁婴幼儿家长做到早发现早治疗,尽量避免病情进展。目前治疗婴幼儿血管瘤的方法较多,包括激光、冷冻、手术、口服激素、口服普萘洛尔以及经皮注射药物硬化治疗等,不同的治疗方式有不同的优缺点,部分甚至会引起一些严重的不良事件。根据当前的医疗理念,治疗原则是以最优的治疗方式取得最佳的治疗效果,如微创或无创治疗,引起的继发性损伤较小,甚至不会在治疗区域遗留疤痕等特点[2]。不同种类的药物在治疗血管瘤中的应用是目前的主要研究方向[3]。非选择性的β受体阻滞剂是目前治疗婴幼儿血管瘤的主要治疗药物,其中普萘洛尔在临床应用中最为广泛,在患儿身体条件允许下口服普萘洛尔治疗血管瘤可以作为常规或首选的治疗方式,并取得了较好的治疗效果,但在治疗过程中也可能会发生恶心、呕吐、腹泻等轻度的胃肠道反应,甚至会诱发或加重支气管哮喘,引起间歇性跛行霍雷诺证等不良反应以及突然停药后的反跳现象。所以婴幼儿口服普萘洛尔治疗血管瘤的过程中务必需要医务人员耐心细致的讲解和指导,加强家长和婴幼儿的高度配合。现将我院门诊口服普萘洛尔治疗婴儿血管瘤的有关疗效报告如下。
1 资料与方法
1.1 临床资料 选择2013年1月1日—2020年8月31日于我院门诊收治的300例婴幼儿血管瘤患儿。其中,男性97例,女性203例;年龄2~7个月;体重4.1~7.9 kg;单发性(1个部位)血管瘤216例,多发性血管瘤(2个或2个以上部位)94例。选取门诊口服普萘洛尔(江苏雅芳爱普森,批准文号E200113)的150例患儿作为观察组;150例患儿口服泼尼松(天方药业,批准文号191111162)的作为对照组。
1.2 纳入标准和排除标准 纳入标准:经彩色多普勒超声(colour doppler ultrasound)、CT(computed tomography)或MRI(magic resonance imaging)诊断明确的血管瘤患者。排除标准:伴有房室传导阻滞、心动过缓、合并支气管哮喘等严重心、肝、肾及肺功能障碍者以及对普萘洛尔药物过敏的患儿。对照组中男性49例,女性101例;平均年龄(3.5±2.1)个月,体重(6.1±1.9)kg;单发血管瘤96例,多发血管瘤54例;病变位于四肢及躯干者103例,病变位于头颈部者47例。观察组中男性52例,女性98例;平均年龄(5.1±1.9)个月,体重(5.7±2.3)kg;血管瘤分型:单发血管瘤93例,多发血管瘤47例;病变位于四肢及躯干者112例,病变位于头颈部者38例。2组患儿的临床资料比较差异无统计学意义(P>0.05),具有可比性。
1.3 方法
1.3.1 用药评估 2组患儿用在药前完善体格检查和各项实验室检查以及心电图,心脏彩色超声,彩色多普勒超声,CT或MRI等各项检查,对患儿进行详细评估。做好患儿的基本信息登记,详细记录血管瘤的类型、部位、面积、表面颜色及深度,以及监护人发现的时间和血管瘤变化情况,判断血管瘤是消退趋势还是迅速增长趋势。
1.3.2 治疗过程 观察组患儿给予普萘洛尔口服治疗,据相关文献报道[4]口服普萘洛尔的安全剂量时1.0~2.0 mg·kg-1·d-1,我院门诊选择按普萘洛尔每日总量1~2.0mg/kg,分3次,每8 h一次口服。初次服药后24 h内门诊留观,监护患儿生命体征变化,无不良反应后家属可带药回家,并详细嘱托家长一定要严格按照医嘱剂量给患儿口服,连续服用3~6个月。治疗过程中注意观查心率、心律、血压、血糖和肝肾功能等指标变化,每次复诊时根据治疗的效果[5]和婴儿体重增长情况调整用药剂量,并详细记录治疗过程中血管瘤的变化情况。择时复查多普勒超声评估血管瘤体积变化,当瘤体缩小没有血供后可逐渐停药,停用药时间根据当时药物剂量大小而定,一般需持续3 d~2周。治疗开始后复诊时间一般第1个月要求每周门诊复诊,第2个月开始每2周复诊,3个月后每月复诊,也可根据个体差异实际情况随时作出调整,安排复诊时间。对照组患儿给予泼尼松口服治疗,使用剂量为3 mg/kg,1次/d。2组患儿的疗程周期均为3~6个月。
1.4 观察指标及疗效判断 标准服用药物3~6个月后依据陈欣玥等[6]提出的4级标准进行疗效评价。Ⅰ级(差):瘤体减少<25%;Ⅱ级(中):瘤体缩小26%~50%;Ⅲ级(好):瘤体缩小51%~75%;Ⅳ级(优):瘤体缩小>75%。通过手工测量、彩色多普勒超声或MRI等方法测量血管瘤的大小。
观察2组患儿的治疗效果,参照相关判断标准[7]:显效:病灶消退超过80%,瘤体消失且皮肤外观正常;有效:病灶消退40%~80%,病灶区域皮肤接近正常肤色;无效:病灶消退低于40%。同时通过触摸感知瘤体软硬度。
1.5 不良反应 观察2组患儿呼吸道变化,低血压,低血糖,失眠或者嗜睡,便秘、腹泻、呕吐等不良反应的发生情况。
1.6 统计学方法 应用PEMS 3.2统计软件处理数据。等级资料比较采用Wilcoxon秩和检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
与用药前相比,观察组在口服普萘洛尔24 h后瘤体的张力均出现不同程度的下降,色泽变淡,瘤体表面温度降低。治疗48~72 h后,触及瘤体可感受到瘤体厚度较前变薄,颜色及质地发生改变后的一段时间内可逐步观察到瘤体体积减小的变化趋势,与相关文献报道一致[8]。在3~6个月的治疗过程中,患者每次复诊时,详细记录血管瘤的大小、颜色、张力、局部皮肤温度以及监护人的观察和记录,用药反应,有无不良反应等,观察组患儿治疗1周有效率达97.6%,且用药时间越长效果越好。所有患儿停药后均无复发。
治疗3~6个月后,观察组患儿显效64例(42.67%),有效77例(51.33%),无效9例(6.00%),总有效率94.00%;对照组患儿显效51例(34.0%),有效73例(48.6%),无效26例(17.33%),总有效率82.67%,结果显示对照组治疗总有效率(82.67%)明显低于观察组总有效率(94.00%)。参照Achauer疗效评定法,结果显示观察组治疗效果显著优于对照组,见表1。
表1 疗程3~6个月参照Achauer疗效评定结果
Table 1 Efficacy evaluation results of treatment at 3-6 months based on Achauer (n=150,例数)

分组Ⅰ级Ⅱ级Ⅲ级Ⅳ级观察组477267对照组12186753U值70.833P值<0.001
在随访过程中,观察2组患儿的呼吸道变化,低血压、低血糖、便秘、腹泻、呕吐等不良反应的发生情况。对照组有8例患儿(约占5%)出现轻度腹泻高于观察组3例(约占2%),经对症治疗后未再出现腹泻症状,腹泻期间未影响婴儿正常发育,也未影响持续的药物治疗,1例患儿出现便秘,5例患儿(约占3%)血糖值低于正常低限,告知家属注意用药和饮食间隔的时间,同时注意观察患儿是否出现失眠或嗜睡等情况。对照组因应用激素后抵抗力降低,出现68例(约占45%)呼吸道疾病,明显高于观察组11例(约占7%)。2组患儿均无低血压等情况出现,化验室检查肝肾功能均无异常。结果显示普萘洛尔治疗血管瘤引起的不良反应明显低于激素治疗组,差异有统计学意义(P<0.05),见表2。
表2 2组不良反应发生情况比较
Table 2 Comparison of adverse reactions between two groups (n=150,例数)
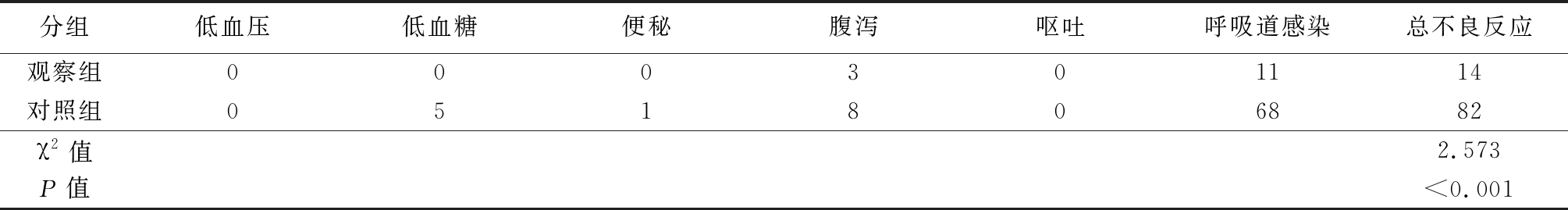
分组低血压低血糖便秘腹泻呕吐呼吸道感染总不良反应观察组000301114对照组051806882χ2值2.573P值<0.001
从观察组选择一个具有代表性的案例,患者4个月男婴,体重12 kg,血管瘤外观颜色深,表面有出血,质地较硬,测量病变部位7.0 cm×5.0 cm×1.0 cm,经彩色多谱乐超声明确诊断为背部婴幼儿血管瘤(图1A)。用药前完善各项相关检查,排除口服普萘洛尔禁忌证。对患儿进行综合评估后确定治疗方案,给予普萘洛尔1.0 mg·kg-1·d-1 8 h/次口服。持续正规治疗五个月后观察到瘤体体积较治疗前明显缩小,颜色变淡,质地变软,从外观来看,治疗后与治疗前形成明显的对比(图1B)。复查彩色多普勒超声,提示瘤体内已无血供信号,考虑可逐渐降低剂量,方法为12 h/次口服,连用3 d,1次/d,口服连用3 d,1周后停用。通过用药前后对比证实了口服普萘洛尔治疗血管瘤的治疗效果,在治疗过程中该患儿未见以上报道的不良反应。可以得出口服普萘洛尔治疗婴幼儿血管瘤是一种安全有效的治疗方式。
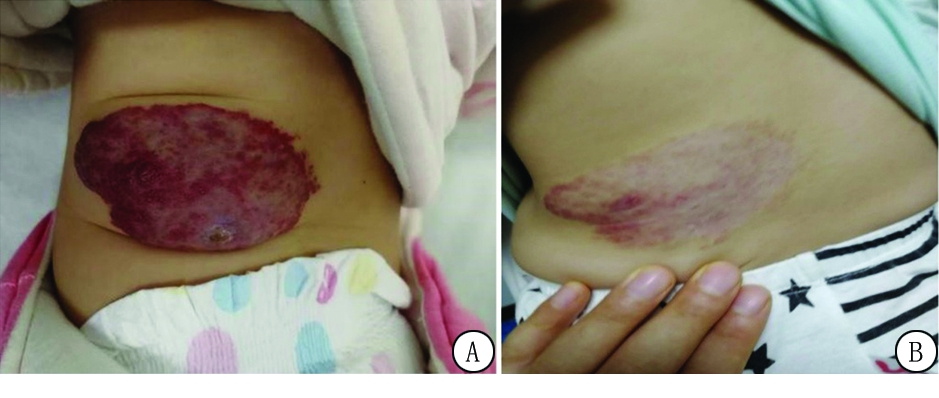
图1 普萘洛尔治疗前后
A.治疗前;B.治疗后
Figure 1 Effect of propranolol before and after treatment
3 讨 论
普萘洛尔最初用来治疗心血管疾病的药物,后被发现对血管瘤同样有治疗效果,国内外相继有学者报道了其对血管瘤疗效显著,现已广泛应用于婴幼儿血管瘤的临床治疗中[9]。考虑到婴儿期是儿童生长发育较快的时期,故对于药物的敏感性和剂量的准确性仍需特别谨慎。在药物治疗前应详细告知监护人普萘洛尔治疗血管瘤的适应证、用法、剂量和可能存在的不良反应。同时,在治疗的过程中,临床医护人员要严格观察并记录药物的治疗效果和不良反应的发生情况。因为婴儿年龄小,对药物敏感度更高,加上治疗周期较长,一般为3~6个月,甚至更长,在用药期间需反复告知监护人,药量不可擅自增减,更不能随意停药,必须在医师的正确指导下进行治疗,并逐渐降低剂量,至少经过3 d,一般为2周。而在服药过程中患儿家长的依从性非常重要,确保安全有效,因此取得家长的理解和积极配合尤其关键,进而提高治疗记录的准确性和可靠性。
口服普萘洛尔后,经过胃肠道吸收,循环到肝内进行代谢,生物利用度可达30%,血药浓度峰值出现在服药后1.0~1.5 h,药物消除半衰期约为服药后2~3 h,血浆蛋白结合率为90%~95%[10],为保证在整个治疗过程中能维持有效的血药浓度,结合治疗中药物存在的不良反应情况,我院门诊选择8 h给药1次。由于婴儿年龄小不能主动配合服药,为了保证药物剂量准确,婴幼儿在首次服用时应安排有经验的医护人员进行示范性操作,以确保家长准确掌握如何正确的给患儿服药。具体做法如下:把普萘洛尔10 mg溶于10 mL温开水中,每1 mL溶液中含药量1 mg。待药剂完全溶解均匀后用注射器抽取医嘱剂量的药物溶液喂给患儿。在喂药过程中要注意避免患儿呛咳或呕吐造成服药剂量不准,且不可与其他药物混起喂服。建议在进食后间隔适当时间再进行服药,进食时间太短服药容易引起呕吐,以防发生窒息和因呕吐导致的服药剂量不准确,故宜选择在进食60 min后服药。普萘洛尔归属于β受体阻滞剂,降低脂肪分解、糖原分解和糖异生是其主要的药理作用,服药后存在低血糖的情况,所以应尽量避免空腹服药。普萘洛尔与食物同服可延缓肝内代谢,提高生物利用度,因此进食后间隔60 min是较为理想的服药时间。普萘洛尔为非选择性竞争抑制肾上腺素β受体阻滞剂,可导致心动过缓、低血压、心力衰竭,低血糖,支气管痉挛等不良反应。因此患儿不可直接离院自行服药,需在口服普萘洛尔1 h内监测[11]患儿血压、心率、心律、呼吸等情况,门诊留观24 h后无异常可准许家属带药回家按医嘱剂量口服。离院时嘱患儿家长在服药期间应密切观察有可能出现的各种不良反应,并详细告知在出现不良反应后的应对措施。
婴儿血管瘤是一种起源于血管内皮细胞的良性肿瘤,依据流行病学调查结果显示大多数瘤体存在自然消退的可能。大约20%的婴儿血管瘤,因父母担心预后要求及早治疗,或因瘤体快速生长导致对周围器官组织的压迫,进而影响正常的生理功能,甚至瘤体位于气道等特殊部位并危及生命而需要进行临床治疗[12]。婴幼儿血管瘤生长的整个过程可以分为3个阶段,包括快速增殖期(<1岁)、增殖消退期(1~5岁)及消退完成期(6~10岁)[13]。其中,快速增值期是我们选择血管瘤治疗的最佳时期,也是我们在本次研究中将治疗周期定为3~6个月的主要依据。关于普萘洛尔在治疗婴幼儿血管瘤中的具体机制目前仍未明确[14],目前已知的可能机制包括引起血管瘤增殖因子碱性成纤维细胞生长因子和血管瘤内皮生长因子(vascular endothelial growth factor,VEGF)表达的下调,促使瘤体血管收缩以及可能诱导血管内皮细胞的凋亡等。快速增殖期的血管瘤内皮细胞高度表达VEGF,而在消退期,VEGF水平则明显下降。普萘洛尔属于β受体的阻滞剂,能选择性的β肾上腺素受体相结合,从而拮抗神经递质和儿茶酚胺对β受体的激动作用。自将普萘洛尔应用于婴幼儿血管瘤的治疗以来,各个治疗中心均取得了较为满意的治疗效果,且相较于传统的激素治疗,普萘洛尔在具有良好的治疗效果的同时,不良反应也较小,目前国内外专家倾向于将普萘洛尔作为一线用药[15],这与我院在治疗过程中所观察到的结果也是一致的。
目前,有报道指出普萘洛尔治疗不同部位的血管瘤也取得了很好的治疗效果,且无明显的不良反应[16]。我院在应用口服普萘洛尔治疗血管瘤的过程中也取得了显著的治疗效果。尽管在临床治疗中普萘洛尔治疗效果理想,但也不能完全忽视治疗过程中可能存在的治疗风险。患儿口服普萘洛尔治疗血管瘤期间仍可能出现支气管痉挛、血压降低、血糖降低和心率减慢等不良反应[17]。因此,在选择用药时。医护人员应严格遵循适应征,保证用药剂量的准确,严密观察及时发现、及时处理服药后出现的不良反应。在本回顾性研究中,观察组治疗效果明显优于对照组,不良反应明显低于对照组,所有患儿在治疗期间均未出现心率减慢、低血压及心力衰竭等严重并发症,可能与最初选择纳入及排除标准有关。同时患儿均未出现严重的低血糖情况, 3~6个月的治疗过程,两组患儿按要求复诊率高达99.7%,这与我院医护人员与家属积极有效的沟通和指导密不可分。患儿按时复诊,也确保了根据疗效和体重变化调整剂量的时效性,避免了严重并发症的发生。因此,婴儿血管瘤可首选口服普萘洛尔治疗,进而抑制血管瘤的快速增长,缩短自行性消退的时间,避免病情的进一步发展。同时,用药前医护人员与家属之间的及时沟通和指导也十分重要,确保患儿家长严格依照治疗方案给予患儿服药也是取得满意治疗效果的重要保证。
综上所述,本研究证实了普萘洛尔确实能安全有效地治疗婴幼儿血管瘤,且不良反应较小,对患儿远期的生长发育也无明显影响[18]。同时认为在门诊接受口服普萘洛尔治疗,缩短了婴儿的在院时间,减少了其院内感染的机会。在婴幼儿成长最关键的时期,最大限度地保证患儿远离医院环境,给其提供舒适安全的成长环境尤为重要,同时也减轻了住院治疗给家长带来的经济负担。
[1] 韦敬,冯红超,邵敏,等.口服普萘洛尔治疗26例婴幼儿颌面部血管瘤临床疗效观察与分析[J].贵州医药,2017,41(3):276-278.
[2] 刘海金,刘潜,傅忠,等.普萘洛尔治疗婴幼儿头面部血管瘤21例[J].实用医学杂志,2012,28(19):3285-3287.
[3] 李燕,张瑞丽.异甘草素对小儿血管瘤内皮细胞生物学特性及PI3K/AKT信号通路的影响[J].郑州大学学报(医学版),2019,54(1):24-28.
[4] 陈远征,白南,李雪晴,等.口服不同剂量普萘洛尔治疗婴幼儿血管瘤的前瞻性随机对照研究[J].中华整形外科杂志,2018(5):337-342.
[5] 谢帅,郭军.普萘洛尔联合马来酸噻吗洛尔治疗婴幼儿血管瘤的护理效果[J].当代护士(上旬刊),2018,25(31):118-120.
[6] 陈欣玥,舒虹,冯建华,等.口服普萘洛尔联合外用马来酸噻吗洛尔滴眼液治疗婴幼儿血管瘤的近期疗效和安全性评价[J].皮肤病与性病,2015,37(6):8-11.
[7] 金云波,林晓曦,叶肖肖,等.普萘洛尔作为严重婴幼儿血管瘤一线治疗的前瞻性研究[J].中华整形外科杂志,2015,27(3):170-173.
[8] 陈彬,吕东泽,朱佳芳,等.普萘洛尔和噻吗洛尔对血管瘤干细胞增殖与凋亡的影响[J].中华整形外科杂志,2018,34(5):379-384.
[9] 赵志国,潘遥,杨东升,等.口服普萘洛尔治疗婴幼儿鼻部血管瘤临床疗效评价[J].中国口腔颌面外科杂志,2017,15(2):161-164.
[10] Assem H,Rambau PF,Lee S,et al. High-grade endometrioid carcinoma of the ovary:a clinicopathologic study of 30 cases[J]. Am J Surg Pathol,2018,42(4):1.
[11] 谢帅,郭军.普萘洛尔联合马来酸噻吗洛尔治疗婴幼儿血管瘤的护理效果[J].当代护士(上旬刊),2018,25(11):118-120.
[12] 鲁红松,蒋冠.0.5%噻吗洛尔滴眼液治疗浅表型婴幼儿血管瘤的疗效观察[J].临床皮肤科杂志,2017,46(2):137-138.
[13] 刘笑宇,李丽,尉莉,等.2%卡替洛尔溶液局部治疗婴儿血管瘤的疗效及安全性研究[J].临床皮肤科杂志,2017,46(1):68-70.
[14] 杨晓燕,刘盛秀.抑癌基因p53在血管瘤发生及靶向治疗中的作用[J].皮肤性病诊疗学杂志,2019,26(5):59-62.
[15] 陈剑伟,原博,张再重,等.普萘洛尔不同给药途径对浅表型小面积婴幼儿血管瘤的疗效及安全性[J].中国临床研究,2017,30(5):639-641.
[16] 孙龙龙,孙斌,马玉春,等.普萘洛尔与阿替洛尔治疗增殖期婴幼儿血管瘤的临床疗效及安全性对比[J].现代生物医学进展,2018,18(1):108-112.
[17] 侯昉,夏梦,刘文英,等.探讨口服普萘洛尔治疗婴幼儿血管瘤的时机及安全性[J].中华小儿外科杂志,2019,40(10):870-875.
[18] 周一冲,姜润松,赵雄.口服普萘洛尔联合激光治疗婴幼儿头面部血管瘤[J].中国医疗美容,2017,7(11):24-26.