胎儿宫内窘迫(fetal distress,FD)是围产期常见临床综合征,发病率为2.7%~38.5%,是导致新生儿神经系统后遗症及胎儿围产期死亡的常见原因,占围产儿死亡原因首位[1-2]。彩色多普勒超声和电子胎心监护是目前FD应用最为广泛的诊断方法之一,可无创、实时、敏感反映胎儿宫内生长情况,早期发现FD[3-4]。研究证实,血清缺氧诱导因子1α(hypoxia inducible factor 1α,HIF-1α)、游离雌三醇(free estriol,FE3)水平与孕晚期FD发生有关[5-6]。本研究首次分析超声测定脐动脉脉动指数(perfusion index,PI)、阻力指数(resistance index,RI)、收缩末期最大血流速度/舒张末期最大血流速度(maximum end-systolic blood flow velocity/maximum end-diastolic blood flow velocity,S/D)联合血清HIF-1α、FE3对FD的诊断价值及与患儿病情严重程度的关联性,旨在提高对FD早期诊断,指导临床合理治疗,改善围产儿预后。报告如下。
1 资料与方法
1.1 一般资料 选取2017年12月—2020年12月我院发生FD的孕妇100例作为观察组,另选取无FD的健康孕妇30例作为对照组。纳入标准:观察组均经异常电子胎心监护、羊水胎粪污染及脐血血气分析确诊为发生FD;均为单胎、头位妊娠;孕周37~42周;孕妇及家属知情同意。排除标准:超声提示有羊水过多或过少;胎膜早破或己破孕妇;胎儿存在畸形;遗传性疾病;肝、肾等重要器官器质性病变。观察组年龄20~33岁,平均(27.86±2.47)岁,孕周37~41周,平均(38.85±0.76)周,产妇类型:初产妇68例,经产妇32例;对照组年龄20~34岁,平均(28.26±2.62)岁,孕周37~42周,平均(39.09±0.82)周,产妇类型:初产妇21例,经产妇9例。2组一般资料比较差异无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会审批通过。患者知情同意并签署知情同意书。
1.2 方法 所有产妇住院后分娩前进行超声检查及血清HIF-1α、FE3检测。①超声检查:美国GE公司LONGS6彩色多普勒超声检测仪,探头频率2.5~5 MHz。仰卧位,先选取二维模式,观察胎儿、胎盘、羊水有无异常,以胎儿颈背部为中心,行纵向及横向扫查,检查颈部有无脐带压迹,采用彩色多普勒观察有无脐带绕颈,选取胎盘近端脐动脉,取样点:脐带出胎盘处,取样容积2 mm,调整取样线与血管夹角,使夹角<30 °,获取血流频谱图,获取连续5个标准波形图并冻结图像,检测PI、RI、S/D。②血清HIF-1α、FE3检测:抽取外周静脉血5 mL,离心(半径8 cm,3 500 r/min,9 min),取血清,HIF-1α采用酶联免疫吸附法测定(北京中杉金桥生物科技有限公司试剂盒),FE3采用电化学发光分析法测定(ROCHE E602及配套试剂盒)。
1.3 观察指标 ①两组PI、RI、S/D、HIF-1α、FE3。②PI、RI、S/D与HIF-1α、FE3相关性。③PI、RI、S/D、HIF-1α、FE3对FD的诊断价值。④不同病情程度FD孕妇PI、RI、S/D、HIF-1α、FE3。轻度:新生儿Apgar评分≥7分、胎心率>160次/min、羊水Ⅱ度污染;重度:新生儿Apgar评分为<7分、胎心率<120次/min、羊水Ⅲ度污染。⑤FD患儿病情程度影响因素。
1.4 统计学方法 应用统计软件SPSS 22.0分析数据。计数资料比较采用χ2检验,计量资料比较采用独立样本t检验;影响因素采用Logistic回归分析;采用Pearson分析相关性;诊断价值采用受试者工作特征(Receiver operating characteristic curve,ROC)曲线,联合预测实施Logistic二元回归拟合,返回预测概率logit(p),将其作为独立检验变量。P<0.05为差异有统计学意义。
2 结 果
2.1 两组PI、RI、S/D、HIF-1α、FE3比较 观察组PI、FE3低于对照组,RI、S/D、HIF-1α高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组PI、RI、S/D、HIF-1α、FE3比较
Table 1 Comparison of PI, RI, S/D, HIF-1α and Fe3 between two groups![]()

组别例数PIRIS/DHIF-1α(pg/L)FE3(μg/L)观察组1000.96±0.190.64±0.213.29±0.70125.59±31.437.08±1.32对照组301.57±0.360.46±0.132.64±0.5853.62±11.2811.41±2.85t值12.2434.4394.62812.27811.650P值<0.001<0.001<0.001<0.001<0.001
2.2 PI、RI、S/D与HIF-1α、FE3相关性 FD孕妇超声测定脐动脉PI与FE3呈正相关关系(r=0.626,P<0.05),与HIF-1α呈负相关关系(r=-0.752,P<0.05);RI、S/D与FE3呈负相关关系(r=-0.704、-0.578),与HIF-1α呈正相关关系(r=0.789、0.761,P<0.05)。
2.3 PI、RI、S/D、HIF-1α、FE3对FD的诊断价值 绘制PI、RI、S/D、HIF-1α、FE3对FD诊断价值的ROC曲线,显示,联合诊断AUC最大,为0.930,最佳敏感度、特异度分别为91.00%、83.33%。见表2,图2。
表2 PI、RI、S/D、HIF-1α、FE3对FD的诊断价值
Table 2 Diagnostic value of PI, RI, S/D, HIF-1α and FE3 in FD
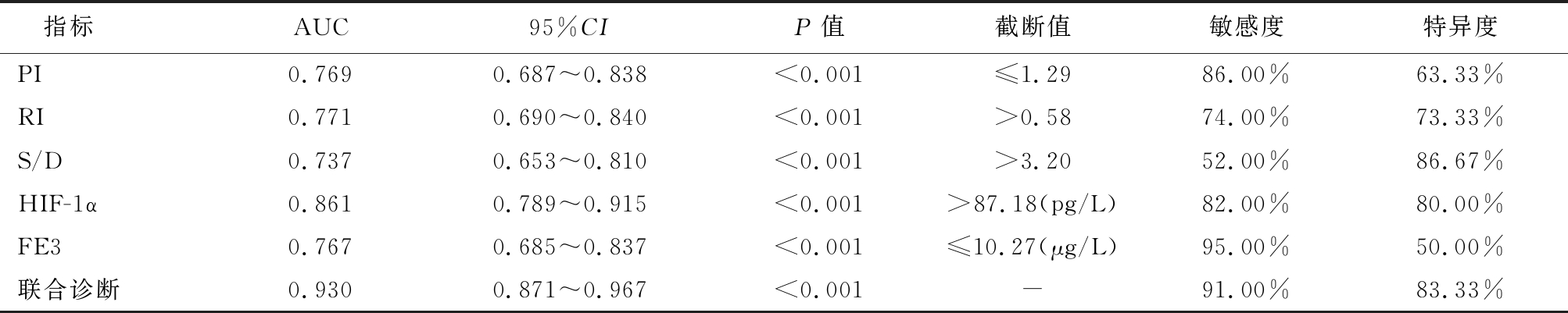
指标AUC95%CIP值截断值敏感度特异度PI0.7690.687~0.838<0.001≤1.2986.00%63.33%RI0.7710.690~0.840<0.001>0.5874.00%73.33%S/D0.7370.653~0.810<0.001>3.2052.00%86.67%HIF-1α0.8610.789~0.915<0.001>87.18(pg/L)82.00%80.00%FE30.7670.685~0.837<0.001≤10.27(μg/L)95.00%50.00%联合诊断0.9300.871~0.967<0.001-91.00%83.33%
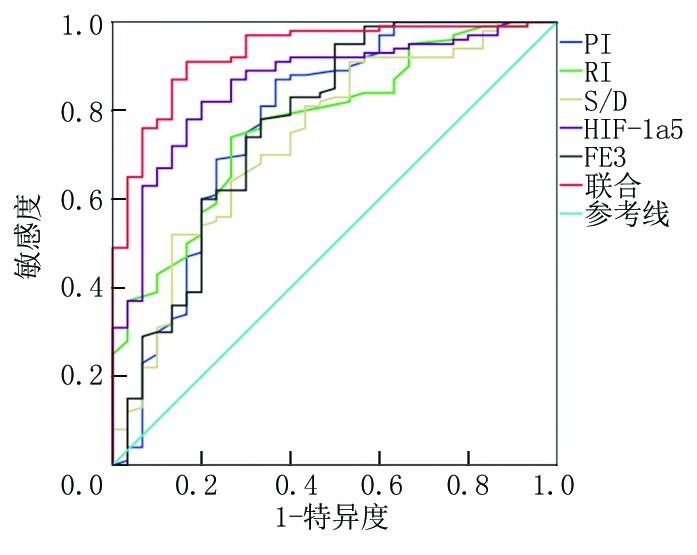
图2 PI、RI、S/D、HIF-1α、FE3对FD的诊断价值
Figure 2 Diagnostic value of PI, RI, S/D, HIF-1α and FE3 in FD
2.4 不同病情程度FD孕妇PI、RI、S/D、HIF-1α、FE3 不同病情程度FD孕妇妊娠高血压疾病、妊娠期糖尿病、脐动脉PI、RI、S/D及血清HIF-1α、FE3水平相比,差异有统计学意义(P<0.05)。见表3。
2.5 FD患儿病情程度影响因素分析 以FD患儿病情程度(轻度=0,重度=1)、脐动脉PI、RI、S/D及血清HIF-1α、FE3水平(均以平均值为界,≤平均值=0,>平均值=1)为因变量,将表3中差异有统计学意义的资料作为自变量纳入Logistic回归分析,可知妊高症、妊娠期糖尿病、脐动脉PI、RI、S/D及血清HIF-1α、FE3水平均为FD患儿病情程度影响因素(P<0.05)。见表4。
表3 不同病情程度FD孕妇PI、RI、S/D、HIF-1α、FE3比较
Table 3 Comparison of PI, RI, S/D, HIF-1α and FE3 in pregnant women with FD of different disease degrees
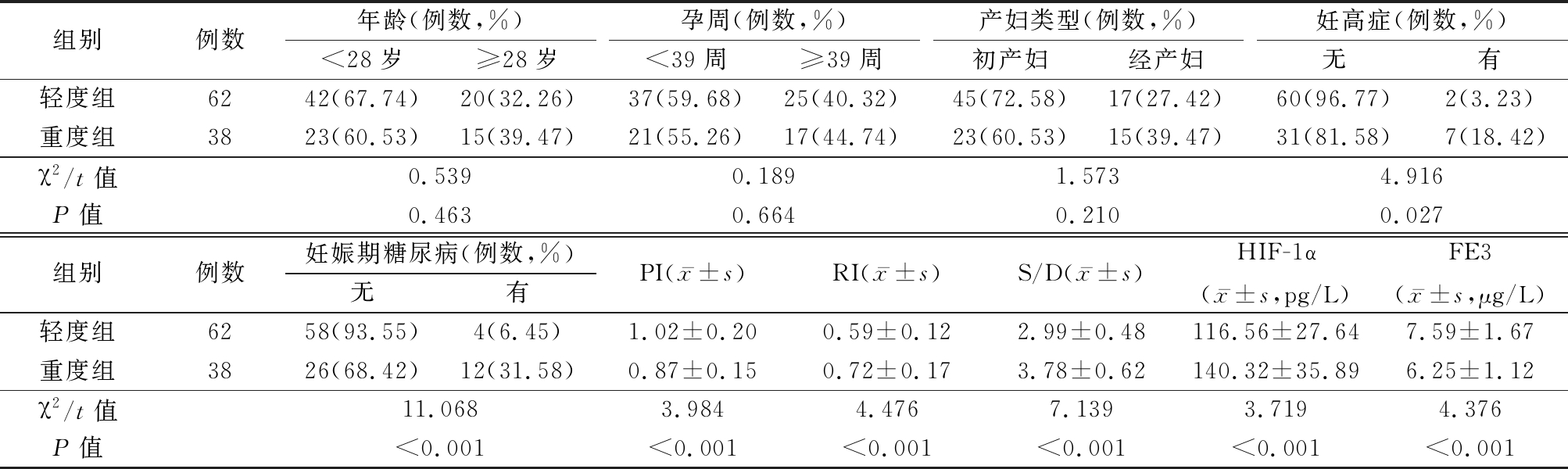
组别例数年龄(例数,%)<28岁≥28岁孕周(例数,%)<39周≥39周产妇类型(例数,%)初产妇经产妇妊高症(例数,%)无有轻度组6242(67.74)20(32.26)37(59.68)25(40.32)45(72.58)17(27.42)60(96.77)2(3.23)重度组3823(60.53)15(39.47)21(55.26)17(44.74)23(60.53)15(39.47)31(81.58)7(18.42)χ2/t值0.5390.1891.5734.916P值0.4630.6640.2100.027组别例数妊娠期糖尿病(例数,%)无有PI(x-±s)RI(x-±s)S/D(x-±s)HIF-1α(x-±s,pg/L)FE3(x-±s,μg/L)轻度组6258(93.55)4(6.45)1.02±0.200.59±0.122.99±0.48116.56±27.647.59±1.67重度组3826(68.42)12(31.58)0.87±0.150.72±0.173.78±0.62140.32±35.896.25±1.12χ2/t值11.0683.9844.4767.1393.7194.376P值<0.001<0.001<0.001<0.001<0.001<0.001
表4 FD患儿病情程度影响因素分析
Table 4 Analysis of influencing factors of disease severity in children with FD
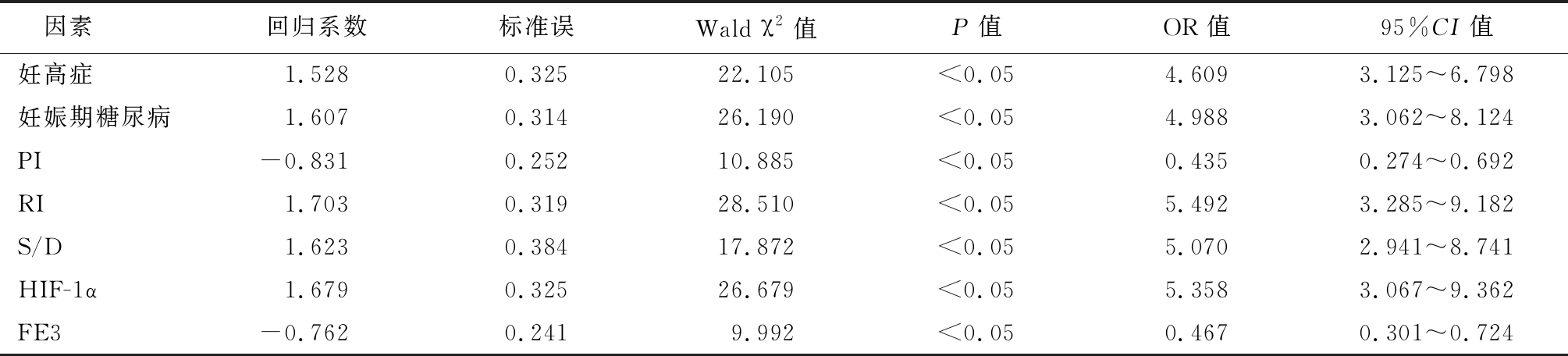
因素回归系数标准误Wald χ2值P值OR值95%CI值妊高症1.5280.32522.105<0.054.6093.125~6.798妊娠期糖尿病1.6070.31426.190<0.054.9883.062~8.124PI-0.8310.25210.885<0.050.4350.274~0.692RI1.7030.31928.510<0.055.4923.285~9.182S/D1.6230.38417.872<0.055.0702.941~8.741HIF-1α1.6790.32526.679<0.055.3583.067~9.362FE3-0.7620.2419.992<0.050.4670.301~0.724
3 讨 论
FD病因包括母胎间血氧运输或交换障碍、母体血液含氧量不足、胎儿自身因素等,其中以脐带异常多见[7-8]。患者在FD早期时确诊,可尽早分析病因,给予针对性早期干预,纠正胎儿缺氧状态,这也是降低新生儿窒息及病死率的关键[9-10]。
彩色多普勒超声具有无创、价格相对低廉、可反复检查等特点,已成为异常产前诊断及胎儿畸形检测的主要手段之一[11]。基础研究认为,胎儿脐动脉血流动力学指数可准确反映脐动脉血流灌注阻力,阻力越高,血流流速越低,胎儿单位时间内血流灌注量不足,出现缺血缺氧性损伤,导致FD发生[12]。本研究结果显示,观察组PI低于对照组,RI、S/D高于对照组(P<0.05),提示脐动脉血流与FD发生有关。李建敏等[13]研究显示,与无FD正常产妇比较,FD产妇RI、S/D升高,PI降低;曹瑞红等[14]研究表明,FD发生风险与脐血流S/D呈正相关。本研究结论均与其一致。生理状况下,脐动脉血流的多普勒频谱呈锯齿状,孕12~14周前无舒张末期血流,随后胎盘三级绒毛内血管迅速分支,血管内径增宽,阻力降低,舒张末期血流信号出现,且流速逐渐增高[15]。因此,脐动脉PI、RI、S/D均随孕周增加而逐渐降低。而高危孕妇易发生全身微小动脉痉挛,导致胎儿缺氧,脐动脉血流阻力上升,舒张末期血流可出现缺失,甚至反向。ROC曲线分析,脐动脉PI、RI、S/D能有效诊断FD,可作为临床诊断FD的重要辅助指标。
HIF-1α是一种核蛋白,仅存在于相对缺氧的细胞核当中,缺氧条件下,特异性结合DNA低氧反应元件上的HIF-1α结合位点,介导低氧反应,是缺氧调节通路上的关键环节之一[16]。HIF-1α是细胞早期对低氧的反应分子之一,生理状况下,各组织细胞中HIF-1α表达甚少,缺氧时显著高表达[17]。孕妇血清中雌三醇多为结合雌激素,其中FE3占9%左右[18]。FE3由胎儿及胎盘共同产生,随孕期不断增加,到分娩前开始降低。体外研究显示,雌三醇可诱导组织产生胰岛素抵抗,诱发妊娠期糖尿病,进而引起广泛血管病变,包括脐动脉血流阻力增加、血管内皮细胞损伤等,进而导致胎儿供血不足,导致胎儿缺血缺氧及FD发生[19]。本研究发现,发生FD的孕妇血清HIF-1α、FE3显著高表达,提示母血清HIF-1α、FE3可能为FD监测指标,与既往研究[20-21]一致。ROC曲线结果显示,血清HIF-1α>87.18 pg/L、FE3≤10.27 μg/L时,应高度警惕FD发生,为临床诊断FD提供新途径。
相关性分析显示,FD孕妇超声测定脐动脉PI与FE3呈正相关关系,与HIF-1α呈负相关关系,RI、S/D与FE3呈负相关关系,与HIF-1α呈正相关关系。因此,本研究创新性采用脐动脉PI、RI、S/D及血清HIF-1α、FE3联合诊断FD,ROC曲线显示,联合诊断AUC最大,为0.930,高于各指标单独诊断。提示各指标联合可为临床诊断PD提供更多参考依据,有助于FD早期检出。本研究Logistic回归分析显示,脐动脉PI、RI、S/D及血清HIF-1α、FE3水平均为FD患儿病情程度影响因素(P<0.05)。提示脐动脉PI、RI、S/D及血清HIF-1α、FE3不仅可有效诊断PD,还可对PD患儿病情严重程度进行分析,进而指导临床合理治疗,改善围产儿预后。
综上可知,FD孕妇超声测定脐动脉PI、RI、S/D与血清HIF-1α、FE3表达相关,各指标联合可提高FD诊断效能,且可预测患儿病情严重程度,并为临床治疗方案制定提高依据,降低母婴风险。
[1] Lindqvist PG,Silva AT,Gustafsson SA,et al. Maternal vitamin D deficiency and fetal distress/birth asphyxia: a population-based nested case-control study[J]. BMJ Open,2016,6(9):e009733.
[2] 李小花,张忠路,张晓红,等.超声检测动脉搏动指数及静脉导管分流率在预测胎儿宫内窘迫出生结局中的价值[J].中国计划生育和妇产科,2019,11(4):55-58.
[3] 贺晓,张建江,滑少华,等.不同类型胆道闭锁患儿的超声影像特点[J].郑州大学学报(医学版),2020,55(5):733-736.
[4] 陈剑超,周杰,李晶.胎儿肾动脉、大脑中动脉及静脉导管分流率检查对诊断妊高症患者胎儿宫内窘迫的临床价值[J].中南医学科学杂志,2020,48(1):52-55.
[5] 沈张颖.孕妇血清缺氧诱导因子-α、促红细胞生成素检测联合三维超声预测胎儿窘迫的价值分析[J].中国妇幼保健,2020,35(11):2137-2140.
[6] 陈霏,王碧.血清游离雌三醇和脂联素水平与妊娠糖尿病孕晚期发生胎儿窘迫的相关性研究[J].现代检验医学杂志,2019,34(6):101-104.
[7] Yazawa H,Takiguchi K,Ito F,et al. Uterine rupture at 33rd week of gestation after laparoscopic myomectomy with signs of fetal distress. A case report and review of literature[J]. Taiwan J Obstet Gynecol,2018,57(2):304-310.
[8] Wang L,Kuromaki K,Kawabe A,et al. Nuchal cord complication in male small for gestational age increases fetal distress risk during labor[J]. Taiwan J Obstet Gynecol,2016,55(4):568-574.
[9] 张雪娟,吴静,杨敬春.彩色多普勒超声检测胎儿脐动脉及大脑中动脉血流频谱对预测宫内窘迫的临床价值分析[J].中国数字医学,2020,15(10):117-118,116.
[10] 罗爱华,包容,吴田田,等.彩色多普勒超声血流显像技术联合胎心无负荷试验诊断胎儿宫内窘迫的价值[J].实用临床医药杂志,2020,24(20):100-102,107.
[11] 刘倩,蒋波,杜新阳,等.彩色多普勒超声在宫内窘迫胎儿脑、肾脏及脐动脉血流检测中的价值研究[J].中国妇幼保健,2020,35(3):576-578.
[12] Edipoglu IS, Celik F,Marangoz EC,et al. Effect of anaesthetic technique on neonatal morbidity in emergency caesarean section for foetal distress[J]. PLoS One,2018,13(11):e0207388.
[13] 李建敏,李娜,周玲,等.超声脐动脉血流联合血清β-HCG、胎心监护预测胎儿宫内窘迫的价值[J].中国医师杂志,2020,22(2):295-298.
[14] 曹瑞红,武斌杰,王亮芝.胎心监测联合脐血流S/D检测对胎儿窘迫的预测价值研究[J].中国实用医药,2017,12(6):62-63.
[15] 丁洁.胎儿脐动脉、大脑中动脉及肾动脉血流参数及其比值对胎儿宫内窘迫的诊断价值[D].苏州:苏州大学,2017.
[16] Lu Y,Ji N,Wei W,et al. MiR-142 modulates human pancreatic cancer proliferation and invasion by targeting hypoxia-inducible factor 1(HIF-1α) in the tumor microenvironments[J]. Biol Open,2017,6(2):252-259.
[17] 赵丽萍,谢文霞.天冬氨酰-β-羟化酶、缺氧诱导因子-1α和血管内皮生长因子在稽留流产绒毛中的表达及意义[J].中国妇产科临床杂志,2017,18(2):164-165.
[18] Hur J,Cho EH,Baek KH,et al. Prediction of gestational diabetes mellitus by unconjugated estriol levels in maternal serum[J]. Int J Med Sci,2017,14(2):123-127.
[19] 季洁,唐龙英.胎儿多普勒超声测定S/D值联合母体血清游离雌三醇预测胎儿宫内生长受限的临床价值[J].山西医药杂志,2020,49(20):2792-2793.
[20] 李建敏,李娜,郭娟,等.彩超联合血清HIF-1α检测对妊娠期高血压疾病患者胎儿宫内窘迫的诊断价值[J].中国医师杂志,2020,22(6):932-934.
[21] 蔡燕,刘一勤.孕妇血雌三醇、胎心电子监护及超声脐动脉血流S/D比值检查预测胎儿窘迫的临床价值分析[J].临床和实验医学杂志,2018,17(2):196-200.