胸腔镜下肺楔形切除术为临床治疗胸科肺部疾病常用术式,具有创伤小、术后恢复快等优势,但通常情况下术后常伴有强烈痛感,若未能采取有效措施抑制创伤所致应激反应,后续可能引发全身炎性反应,影响患者术后康复进程[1-2]。选择安全、有效术后镇痛方案为麻醉医生极其重要任务,竖脊肌平面阻滞是于竖脊肌平面注射麻醉药,可实现麻醉药向尾部四个椎体和向头端三个椎体水平的扩展,不但对交感神经纤维产生阻滞效应,还可缓解内脏痛[3]。既往研究报道,竖脊肌平面阻滞可有效缓解肾脏手术[4]术后疼痛,更有研究表明,竖脊肌平面阻滞可作为硬膜外镇痛失败补救的镇痛技术[5]。但目前关于竖脊肌平面阻滞应用于胸腔镜下肺楔形切除术的术后镇痛效果、应激控制情况如何报道较少,本研究以胸腔镜肺叶切除术患者为研究对象,从疼痛-舒适程度、心理状态、应激激素及相关细胞因子调节效应等方面入手,探讨竖脊肌平面阻滞的应用价值。现报道如下。
1 资料与方法
1.1 一般资料 选取2018年9月—2020年9月行胸腔镜下肺楔形切除术患者82例为研究对象,采用电脑随机数字表法分为对照组和观察组,每组41例。2组性别、年龄、体重、手术时间、美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级、疾病类型、患侧部位差异均无统计学意义(P>0.05),具有可比性,见表1。
表1 两组一般资料比较
Table 1 Comparison of general data between two groups (n=41)
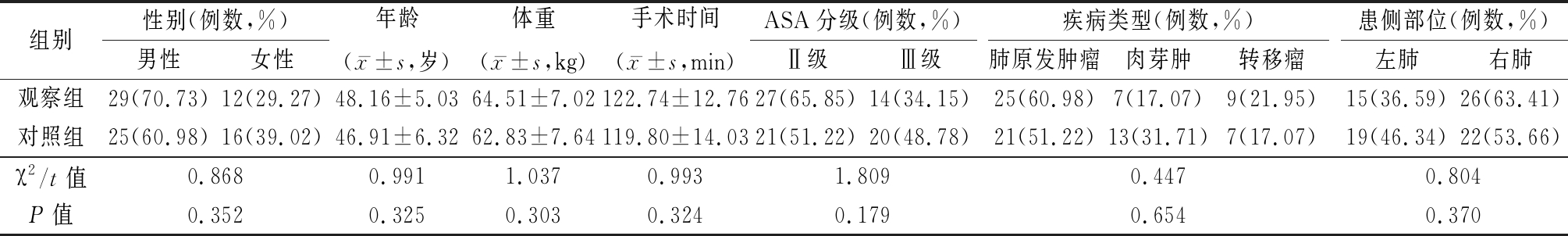
组别性别(例数,%)男性女性年龄(x-±s,岁)体重(x-±s,kg)手术时间(x-±s,min)ASA分级(例数,%)Ⅱ级Ⅲ级疾病类型(例数,%)肺原发肿瘤肉芽肿转移瘤患侧部位(例数,%)左肺右肺观察组29(70.73)12(29.27)48.16±5.0364.51±7.02122.74±12.7627(65.85)14(34.15)25(60.98)7(17.07)9(21.95)15(36.59)26(63.41)对照组25(60.98)16(39.02)46.91±6.3262.83±7.64119.80±14.0321(51.22)20(48.78)21(51.22)13(31.71)7(17.07)19(46.34)22(53.66)χ2/t值0.8680.9911.0370.9931.8090.4470.804P值0.3520.3250.3030.3240.1790.6540.370
1.2 纳入标准和排除标准 纳入标准:符合胸腔镜下肺楔形切除术手术指征;顺利完成手术并苏醒;无精神症状者;初中及以上文化水平,可独立填写调查问卷者;对本研究知情同意并签署知情同意书。
排除标准:既往胸部手术史者;伴有其他部位恶性肿瘤者;具有药物及酒精滥用史者;合并脊柱畸形;目标穿刺部位有明显感染或瘢痕者;长期服用镇痛药物史;妊娠、哺乳期女性;合并甲状腺功能亢进、甲状腺功能减退等影响机体应激状态者;围术期应用免疫抑制剂者。
本研究经医院伦理委员会审批通过。
1.3 方法 2组均常规禁饮禁食,开放外周静脉,予以心电监护,检测鼻咽温及脑电双频指数;术前肌注苯巴比妥钠0.1 g、阿托品0.5 mg,于超声引导下完成神经阻滞,建立桡动脉有创血压监测;静脉注射咪达唑仑0.02~0.05 mg/kg、舒芬太尼0.5 μg/kg、依托咪酯0.3~0.4 mg/kg、罗库溴铵0.6~1.2 mg/kg予以麻醉诱导;进行面罩通气,待肌松弛、脑电双频指数<50后进行机械通气,呼气末二氧化碳维持在35~45 mmHg(1 mmHg=0.133 kPa),血氧饱和度>95%;术中采用全凭静脉麻醉维持,持续泵注丙泊酚4~6 mg·kg-1·h-1、瑞芬太尼12~20 μg·kg-1·h-1、右美托咪定0.2~0.7 μg·kg-1·h-1,按需追加罗库溴铵0.1~0.2 mg/kg,确保血压波动范围不超过基础值的20%,若平均动脉压<基线值20%,静脉注射去甲肾上腺素4 μg;维持脑电双频指数值在40~60,手术结束后所有患者均进入麻醉恢复室进行监测与麻醉复苏。
对照组:采用静脉自控镇痛(patient-controlled intravenous analgesia,PCIA),术后6 h连接静脉自控镇痛泵PCIA持续镇痛,负荷量5 mL,PCIA药物组成:舒芬太尼0.15 μg/kg、昂丹司琼8~12 mg加生理盐水稀释至200 mL,单次给药量0.5 mL,持续剂量1.0 mL/h,追加剂量3.0 mL/次,锁时20 min,术后48 h撤掉镇痛泵。
观察组:采用单次竖脊肌平面阻滞+PCIA,麻醉诱导前超声引导下实施竖脊肌平面阻滞,患者取健侧卧位,首先行体表定位,一般两侧尖角下角连线对应为第七胸椎,向上两个节段即第五胸椎;扫描T5棘突,超声可见T5或T6横突,横突表面覆盖菱形肌、竖脊肌、斜方肌;平面内进针,针尖触及横突骨质后,进针约35~60 mm,回抽无气体或出血后,注入0.5%罗哌卡因5 mg+地塞米松20 mL,可见局麻药在竖脊肌平面内扩散(超声显示为向头尾扩散的液性暗区);术后6 h连接静脉自控镇痛泵,具体操作同对照组一致。
1.4 观察指标 2组手术相关情况、平均动脉压(mean arterial pressure,MAP)、心率(heart rate,HR)、安全性。①手术相关情况:包括手术时间、术中舒芬太尼用量、术中出血量、术后24 h PCIA按压次数、住院时间。②MAP、HR:记录2组麻醉诱导前、置入双腔管时、切皮时、拔管时MAP、HR水平。③安全性:记录2组不良反应发生情况,包括恶心呕吐等。
2组术前、术后1d、2 d、3 d、4 d疼痛视觉模拟评分法(visual analogue scale,VAS)、Kolcaba的舒适状况量表(general comfort questionnaire,GCQ)、状态-特质焦虑问卷(state-trait anxiety inventory,STAI)、心理状态、应激激素、肺表面活性蛋白质A(surfactant protein A,SP-A)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)。①疼痛-舒适程度:参照VAS评估患者疼痛情况,总分0~10分,0分为无痛,10分为剧烈疼痛,得分越高,疼痛越严重[6];参照GCQ评估患者舒适程度,包括生理、心理精神、社会文化项、环境4个维度,总分30~120分,得分越高代表越舒适。该量表整体Cronbach′s α系数为0.821,具有较高内部一致性[7]。②心理状态:参照STAI评估患者心理状态,STAI包括特质焦虑(trait-anxiety inventory,T-AI)、状态焦虑(state-anxiety inventory,S-AI)两个分量表,各20个条目,分量表分值范围均为20~80分,得分越低代表焦虑状态越轻,受试者需具有初中文化水平[8]。③应激激素及SP-A、TNF-α:采集患者空腹静脉血2 mL,选用低温离心机,以半径8 cm、转速3500 r/min离心10 min,取上清液并保存于-20 ℃环境中,采用酶联反应吸附测定法检测皮质醇(cortisol,Cor)、促肾上腺皮质激素(adrenalcorticotropichormone,ACTH)、前列腺素E2(prostaglandin E2,PGE2)、SP-A、TNF-α,Cor试剂盒由武汉菲恩生物科技有限公司提供;PGE2试剂盒由北京百奥莱博科技有限公司提供;ACTH试剂盒由上海吉至生化科技有限公司提供;SP-A试剂盒由上海广锐生物科技有限公司提供;TNF-α试剂盒由武汉博迪莱莎生物科技有限公司提供。
1.5 统计学方法 应用SPSS 22.0统计软件分析数据。计量资料比较采用独立样本的t检验和重复测量方差分析,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组手术相关情况比较 2组手术时间、术中出血量、住院时间比较差异无统计学意义(P>0.05);观察组术中舒芬太尼用量、术后24 h PCIA按压次数低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 2组手术相关情况比较
Table 2 Comparison of operation-related conditions between two groups![]()
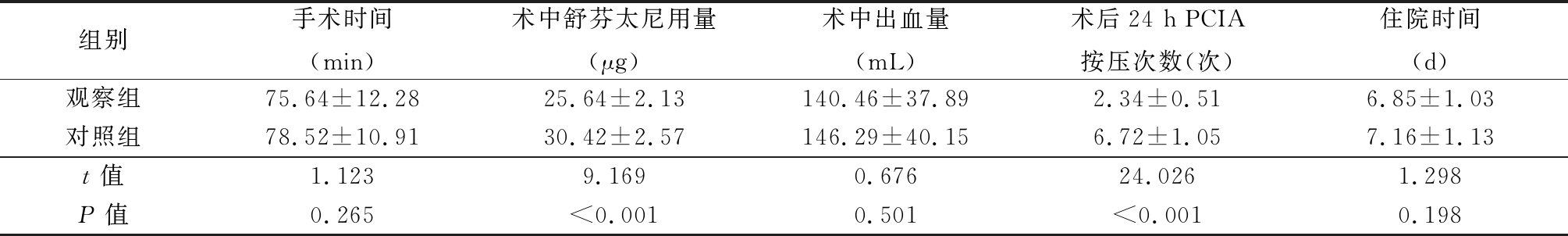
组别手术时间(min)术中舒芬太尼用量(μg)术中出血量(mL)术后24 h PCIA按压次数(次)住院时间(d)观察组75.64±12.2825.64±2.13140.46±37.892.34±0.516.85±1.03对照组78.52±10.9130.42±2.57146.29±40.156.72±1.057.16±1.13t值1.1239.1690.67624.0261.298P值0.265<0.0010.501<0.0010.198
2.2 2组MAP与HR比较 2组MAP、HR组间、时点间、组间·时点间比较,差异有统计学意义(P<0.05);2组置入双腔管时、切皮时、拔管时MAP、HR高于麻醉诱导前(P<0.05),观察组置入双腔管时、切皮时、拔管时MAP、HR低于对照组,差异有统计学意义(P<0.05)。见表3。
表3 2组MAP与HR比较
Table 3 Comparison of MAP and HR between two groups![]()
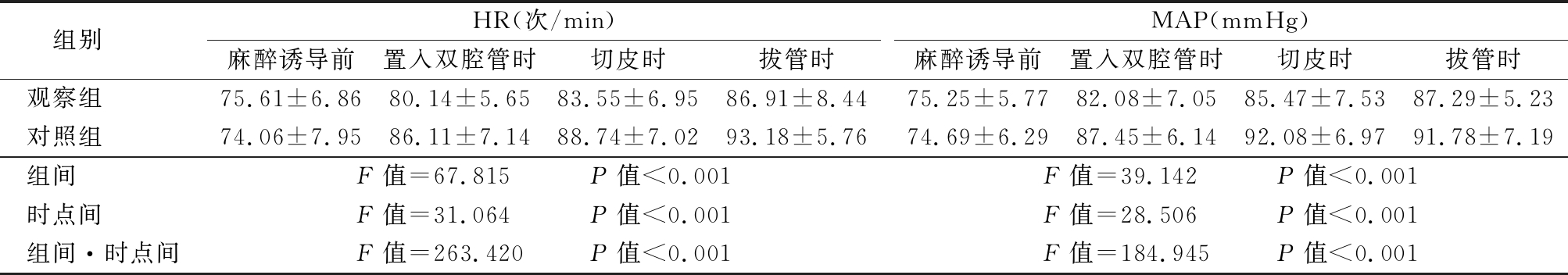
组别 HR(次/min)麻醉诱导前置入双腔管时切皮时拔管时MAP(mmHg)麻醉诱导前置入双腔管时切皮时拔管时观察组 75.61±6.8680.14±5.6583.55±6.9586.91±8.4475.25±5.7782.08±7.0585.47±7.5387.29±5.23对照组 74.06±7.9586.11±7.1488.74±7.0293.18±5.7674.69±6.2987.45±6.1492.08±6.9791.78±7.19组间 F值=67.815 P值<0.001F值=39.142 P值<0.001时点间 F值=31.064 P值<0.001F值=28.506 P值<0.001组间·时点间F值=263.420 P值<0.001F值=184.945 P值<0.001
2.3 术后疼痛-舒适程度、心理状态 2组疼痛VAS评分、GCQ评分、S-AI评分和T-AI评分组间、时点间、组间·时点间比较,差异有统计学意义(P<0.05);2组术后2,3,4 d疼痛VAS评分、S-AI评分和T-AI评分低于术后1 d,GCQ评分高于术后1 d,观察组术后2 d、3 d、4 d疼痛VAS评分、S-AI评分和T-AI评分低于对照组,GCQ评分高于对照组,差异有统计学意义(P<0.05)。见表4。
表4 2组术后疼痛-舒适程度、心理状态比较
Table 4 Comparison of postoperative pain and comfort and psychological status between two groups ![]() 分)
分)
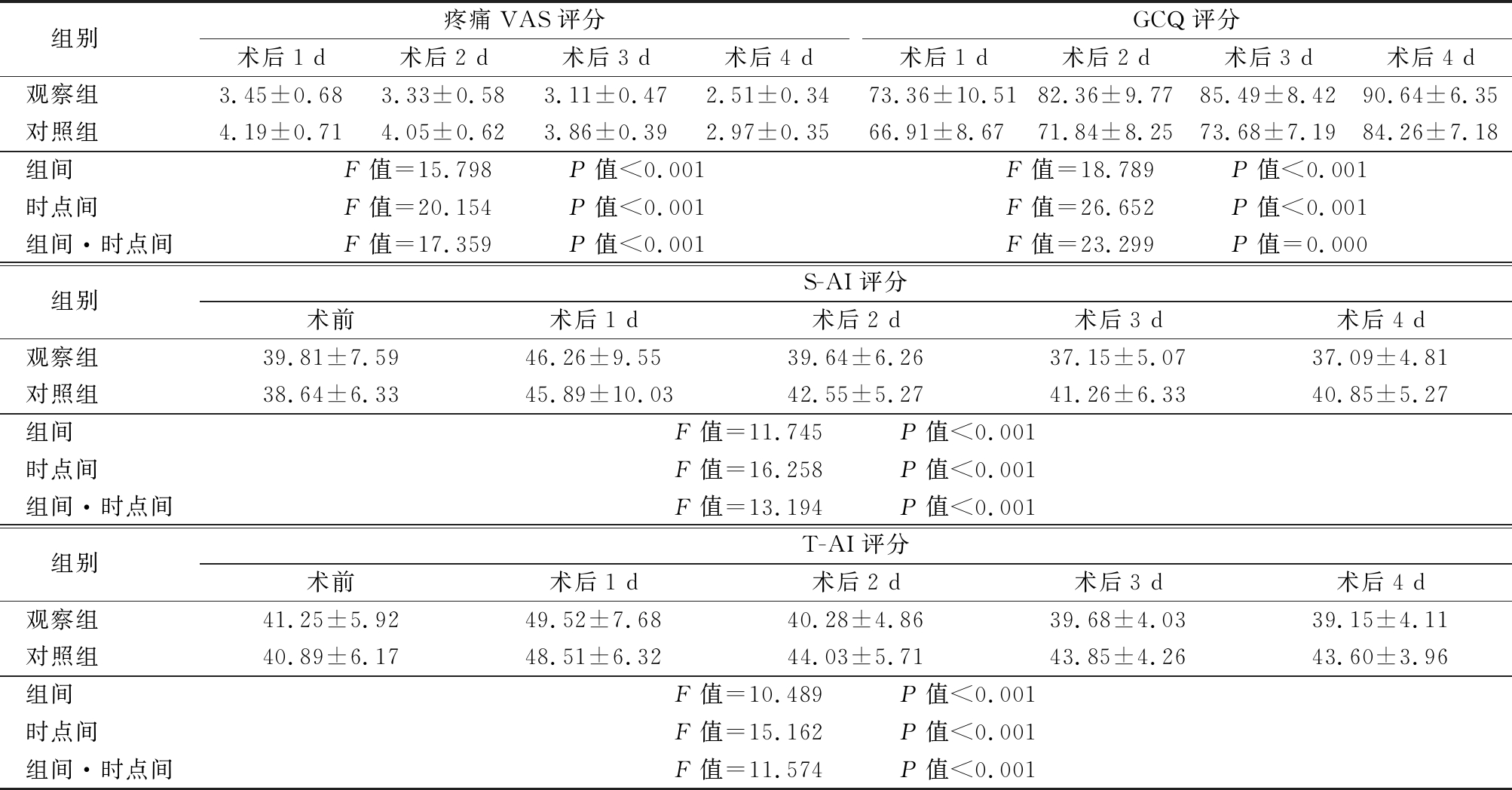
组别 疼痛VAS评分术后1 d术后2 d术后3 d术后4 dGCQ评分术后1 d术后2 d术后3 d术后4 d观察组 3.45±0.683.33±0.583.11±0.472.51±0.3473.36±10.5182.36±9.7785.49±8.4290.64±6.35对照组 4.19±0.714.05±0.623.86±0.392.97±0.3566.91±8.6771.84±8.2573.68±7.1984.26±7.18组间 F值=15.798 P值<0.001F值=18.789 P值<0.001时点间 F值=20.154 P值<0.001F值=26.652 P值<0.001组间·时点间F值=17.359 P值<0.001F值=23.299 P值=0.000组别 S-AI评分术前术后1 d术后2 d术后3 d术后4 d观察组 39.81±7.5946.26±9.5539.64±6.2637.15±5.0737.09±4.81对照组 38.64±6.3345.89±10.0342.55±5.2741.26±6.3340.85±5.27组间 F值=11.745 P值<0.001时点间 F值=16.258 P值<0.001组间·时点间F值=13.194 P值<0.001组别 T-AI评分术前术后1 d术后2 d术后3 d术后4 d观察组 41.25±5.9249.52±7.6840.28±4.8639.68±4.0339.15±4.11对照组 40.89±6.1748.51±6.3244.03±5.7143.85±4.2643.60±3.96组间 F值=10.489 P值<0.001时点间 F值=15.162 P值<0.001组间·时点间F值=11.574 P值<0.001
2.4 2组应激激素比较 2组Cor、ACTH、PGE2组间、时点间、组间·时点间比较,差异有统计学意义(P<0.05);2组术后1,2,3,4 d Cor、ACTH、PGE2较术前显著升高,观察组术后1,2,3,4 d Cor、ACTH、PGE2较对照组显著降低,差异有统计学意义(P<0.05)。见表5。
表5 2组应激激素比较
Table 5 Comparison of stress hormones between two groups![]()
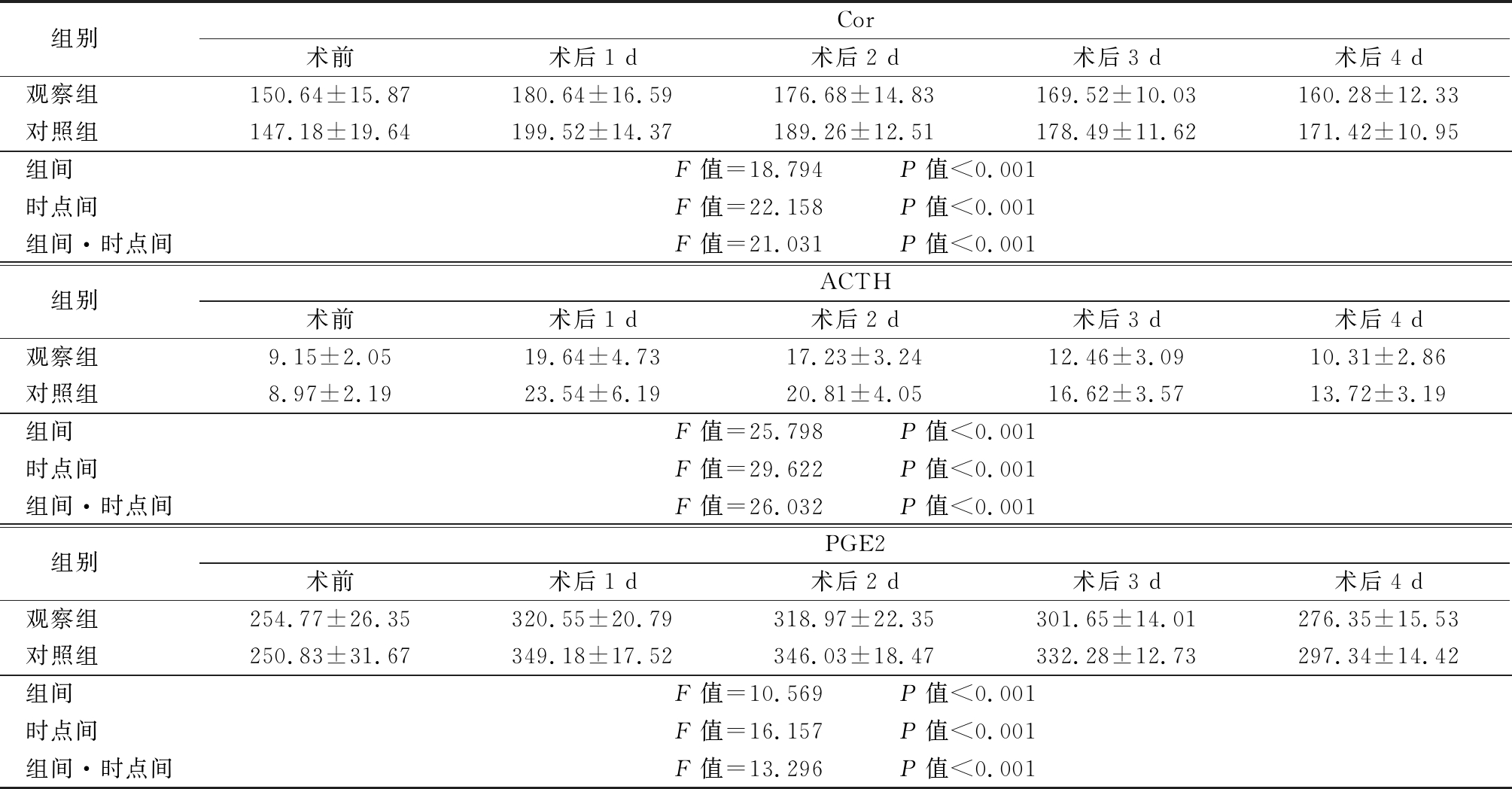
组别 Cor术前术后1 d术后2 d术后3 d术后4 d观察组 150.64±15.87180.64±16.59176.68±14.83169.52±10.03160.28±12.33对照组 147.18±19.64199.52±14.37189.26±12.51178.49±11.62171.42±10.95组间 F值=18.794 P值<0.001时点间 F值=22.158 P值<0.001组间·时点间F值=21.031 P值<0.001组别 ACTH术前术后1 d术后2 d术后3 d术后4 d观察组 9.15±2.0519.64±4.7317.23±3.2412.46±3.0910.31±2.86对照组 8.97±2.1923.54±6.1920.81±4.0516.62±3.5713.72±3.19组间 F值=25.798 P值<0.001时点间 F值=29.622 P值<0.001组间·时点间F值=26.032 P值<0.001组别 PGE2术前术后1 d术后2 d术后3 d术后4 d观察组 254.77±26.35320.55±20.79318.97±22.35301.65±14.01276.35±15.53对照组 250.83±31.67349.18±17.52346.03±18.47332.28±12.73297.34±14.42组间 F值=10.569 P值<0.001时点间 F值=16.157 P值<0.001组间·时点间F值=13.296 P值<0.001
2.5 2组SP-A、TNF-α比较 2组SP-A、TNF-α组间、时点间、组间·时点间比较,差异有统计学意义(P<0.05);2组术后1,2,3,4 d SP-A、TNF-α较术前显著升高,观察组术后低于对照组,差异有统计学意义(P<0.05)。见表6。
表6 2组SP-A、TNF-α比较
Table 6 Comparison of SP-A and TNF-α between two groups![]()
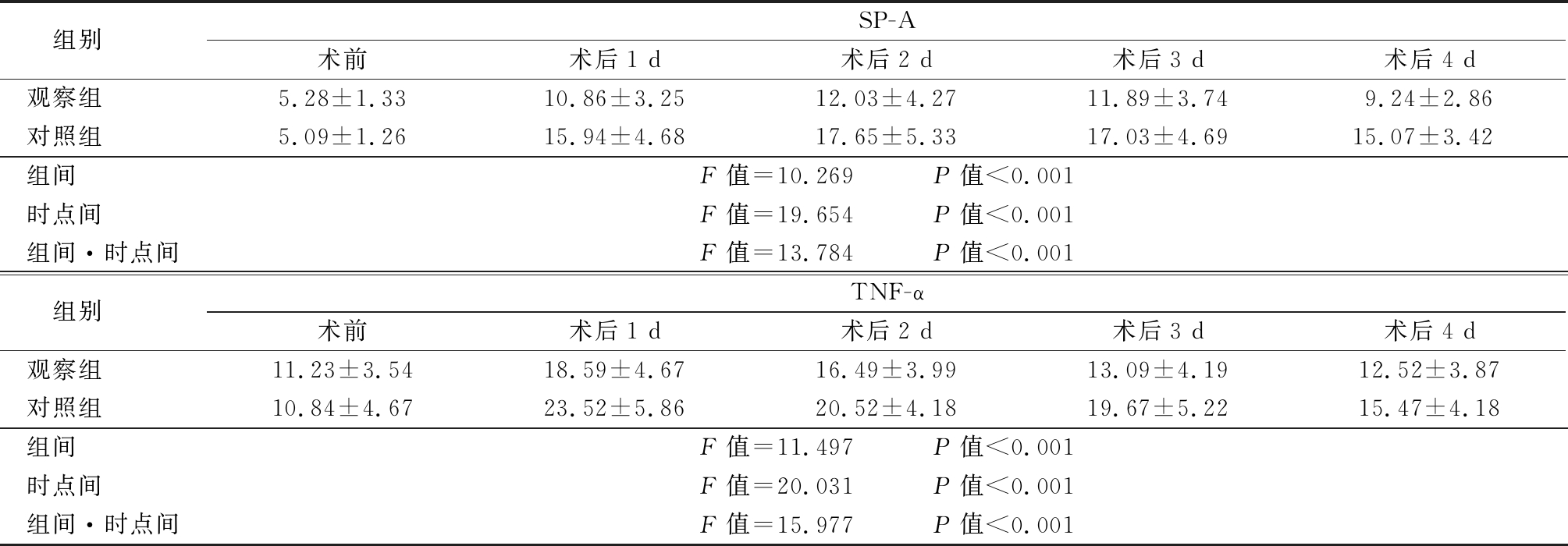
组别 SP-A术前术后1 d术后2 d术后3 d术后4 d观察组 5.28±1.3310.86±3.2512.03±4.2711.89±3.749.24±2.86对照组 5.09±1.2615.94±4.6817.65±5.3317.03±4.6915.07±3.42组间 F值=10.269 P值<0.001时点间 F值=19.654 P值<0.001组间·时点间F值=13.784 P值<0.001组别 TNF-α术前术后1 d术后2 d术后3 d术后4 d观察组 11.23±3.5418.59±4.6716.49±3.9913.09±4.1912.52±3.87对照组 10.84±4.6723.52±5.8620.52±4.1819.67±5.2215.47±4.18组间 F值=11.497 P值<0.001时点间 F值=20.031 P值<0.001组间·时点间F值=15.977 P值<0.001
2.6 两组不良反应比较 观察组出现恶心呕吐1例,对照组出现恶心呕吐3例,2组无其他不良反应发生。观察组不良反应发生率为2.77%(1/41),与对照组的7.32%(3/41)比较差异无统计学意义(χ2=0.263,P=0.608)。
3 讨 论
据报道,胸外科手术后慢性疼痛发生率约为14%~83%,因缺乏有效术后疼痛管理,其发生率居高不下[9]。胸腔镜下肺楔形切除术术后疼痛机制尚不明确,多数学者认为主要与局部皮肤切口损伤、肋间神经损伤以及下行传导通路改变有关,镇痛不完善可能影响患者术后呼吸功能及分泌物排出,引起肺栓塞、肺不张等一系列并发症,导致患者病死率增加[10]。近年来,麻醉医生一直致力于这方面研究,以期通过改善患者术后疼痛情况来提高手术效果和预后。
近年来,随着加速康复外科及其相关医疗技术发展,围术期多模式镇痛方法得到临床重视,提倡联合应用不同作用机制镇痛方法、镇痛药物提高镇痛效果,以减少阿片类药物使用量及相关不良反应。竖脊肌平面阻滞是一种新型躯干神经阻滞技术,于2016年首次应用于严重神经病理性疼痛和急性术后疼痛治疗并取得较好应用效果。在上述研究基础上,本研究尝试将单次竖脊肌平面阻滞与PCIA相联合应用于胸腔镜下肺楔形切除术患者,结果显示,上述麻醉方案同单独应用PCIA相比,置入双腔管时、切皮时、拔管时MAP、HR波动幅度小,同王强等[11]研究结果一致。翁艳等[12]研究结果显示,竖脊肌平面阻滞时所注射局部麻醉药物约20 min即可扩散至椎旁间隙,这可能为竖脊肌平面阻滞能有效发挥镇痛作用的机制。本研究实施超声下竖脊肌平面阻滞可直接将局麻药注射于竖脊肌筋膜深面,进而阻断深面走行脊神经,使药物在筋膜间扩散并浸润目标神经,对手术损伤肋间神经具有良好镇痛作用,有助于维持术中生命体征平稳,促进手术顺利进行。由本研究结果可知,术中舒芬太尼用量、术后24 h PCIA按压次数均减少,术后VAS评分、GCQ评分、S-AI评分和T-AI评分均得到显著改善,笔者推测其原因,单次竖脊肌平面阻滞+PCIA能够在保证平衡前提下,充分利用区域麻醉优势,提高术后镇痛效果,改善其术后舒适度,缓解患者因疼痛所致不良心理状态,且可增加临床对全天候基础镇痛认识,优化止痛剂剂量,以达到最佳效果、减少不良反应。但本研究数据显示,2组不良反应发生率比较差异无统计学意义,可能与本研究选例较少有关。
既往研究证实,手术应激可促使下丘脑-垂体-肾上腺皮质系统兴奋,引起Cor、ACTH升高,同时HPA轴的负反馈机制受损,破坏其昼夜节律,导致Cor、ACTH持续升高,且升高程度同手术刺激程度呈正相关[13-14]。PGE2是具有广泛生理、病理功能的炎性因子,其水平升高可加强缓激肽对伤害性感受器作用,产生持久血管扩张和致痛作用[15]。Cor、ACTH、PGE2作为应激激素在手术创伤研究中得到广泛重视,本研究对上述应激激素进行检测,结果显示,2组术后1,2,3,4 d Cor、ACTH、PGE2较术前显著升高,且观察组较对照组低(P<0.05),可见,胸腔镜下肺楔形切除术患者术后均发生应激反应,但实施单次竖脊肌平面阻滞麻醉镇痛者应激反应较小,其原因可能为竖脊肌平面阻滞可在一定程度上减少术后疼痛介质分泌,进而抑制伤害性刺激产生的应激反应。研究表明,外科手术刺激引起应激反应同时也产生炎症和免疫反应,其中最重要的细胞因子包括TNF-α和SP-A[16-17]。SP-A为免疫活性蛋白,主要由肺泡Ⅱ型上皮细胞分泌,可调节机体免疫反应,维持气道稳定性,抵抗炎症所致肺损伤。TNF-α介导肿瘤免疫应答,反映炎性反应严重程度,对炎性细胞因子释放具有促进作用。围术期镇痛效果同术后炎症、免疫反应息息相关,在本研究中,观察组术后1,2,3,4 d SP-A、TNF-α低于对照组(P<0.05),竖脊肌平面阻滞可阻断胸脊神经腹侧支和背侧支,甚至可阻断交感神经纤维,有助于抑制蓝斑-交感神经-肾上腺髓质系统兴奋,避免促炎症细胞大量分泌,对肺组织发挥保护作用,但具体作用机制还需进一步深入探究。
综上可知,单次竖脊肌平面阻滞+PCIA对胸腔镜下肺楔形切除术患者围手术期镇痛效果显著,可减少麻醉药物用量,减轻机体炎症、免疫反应及手术应激,改善患者心理状态及舒适程度,安全可靠。但本研究亦存在不足之处,笔者仅将0.5%浓度的罗哌卡因用于竖脊肌平面阻滞,而采用其他浓度罗哌卡因是否可取得更佳术后镇痛效果,还需在今后研究中进一步探索。
[1] 刘磊,张毅,支修益,等.胸腔镜下铥激光与机械切割吻合器肺楔形切除术的比较[J].中国微创外科杂志,2019,19(12):1062-1065.
[2] Xu H,Zhang L. The feasibility of thoracoscopic left pneumonectomy[J]. Thorac Cardiovasc Surg,2019,67(2):137-141.
[3] 赵尧平,于双,郑少强,等.超声引导下竖脊肌平面阻滞在慢性脓胸患者术中及术后镇痛中的效果[J].临床麻醉学杂志,2019,35(2):129-132.
[4] 汪雪锋,柴小青,王迪,等.超声引导竖脊肌平面阻滞在腹腔镜肾脏手术中的应用[J].实用医学杂志,2020,36(2):105-108,114.
[5] 王甜.竖脊肌平面阻滞的临床应用研究进展[J].中国微创外科杂志,2018,18(10):927-930.
[6] 王平,王昊,武春雷,等.经皮椎间孔镜技术对腰椎间盘突出合并腰椎管狭窄症老年患者视觉模拟量表评分及Oswestry功能障碍指数的影响[J].中国医学装备,2018,15(12):109-113.
[7] 李彦华,刘瑞云,王霞,等.宫颈癌腔内后装治疗病人舒适状况量表的编制及信效度检验[J].护理研究,2017,31(5):629-631.
[8] 胡晓莉,赵玉芳,宋春艳,等.三因制宜原则指导的健康教育对住院患者STAI评分,疾病认知及自我保健状况的影响[J].现代中西医结合杂志,2020,29(8):897-900.
[9] 罗太君,高广阔,刘伟.胸科术后镇痛的研究进展[J].临床麻醉学杂志,2018,34(9):97-99.
[10] 张潇,孙淳,杨梦成,等.胸腔镜下铥激光肺楔形切除术的安全性分析[J].中国胸心血管外科临床杂志,2019,26(10):52-55.
[11] 王强,郑晖,张国华.单次竖脊肌平面阻滞联合患者自控静脉镇痛用于食管癌根治术术后镇痛的研究[J].国际麻醉学与复苏杂志,2019,40(9):848-851.
[12] 翁艳,钟庆,杨岸,等.竖脊肌平面阻滞在麻醉与疼痛中的临床应用进展[J].医学综述,2019,25(18):3682-3687.
[13] Prete A,Yan Q,Al-Tarrah K,et al. The cortisol stress response induced by surgery:a systematic review and meta-analysis[J]. Clin Endocrinol(Oxf),2018,89(5):554-567.
[14] 陈均,向家勇,母存富,等.不同的手术方案切除恶性纵膈肿瘤对患者ACTH、CRP、TNF-α、COR含量及预后影响的对比分析[J].实用癌症杂志,2019,34(1):86-89.
[15] 何静,郑重,祁富伟,等.右美托咪定复合罗哌卡因超前镇痛对开胸手术病人围术期疼痛控制及血清前列腺素E2,β-内啡肽的影响[J].临床外科杂志,2020,28(8):92-94.
[16] Schad CA,Haac BE,Cross RK,et al. Early postoperative anti-TNF therapy does not increase complications following abdominal surgery in crohn′s disease[J]. Dig Dis Sci,2019,64(7):1959-1966.
[17] 李小虎.微小单孔电视胸腔镜手术对原发自发性气胸患者术后VAS评分及血清TNF-α,IL-1,α1-AT水平的影响[J].医学理论与实践,2020,33(9):1438-1439.