剖宫产术后子宫瘢痕妊娠(cesarean scar pregnancy,CSP)是指受精卵着床于前次剖宫产子宫切口瘢痕处的一种异位妊娠,2016年中华医学会妇产科学分会计划生育学组专家共识规范了定义:将诊断限于早孕期(≤12周),也制定了根据妊娠囊的生长方向以及子宫前壁妊娠囊与膀胱间子宫肌层的厚度显示,进行超声分型[1]。在此分型基础上,结合前期病例特点分析了38例CSP患者,并采用个体化诊疗方案,现报告如下。
1 资料与方法
1.1 一般资料 选择2017年3月—2020年9月我院超声确诊的剖宫产术后子宫瘢痕妊娠患者38例。年龄27~41岁,平均(33.10±4.05)岁,停经后25例有阴道出血,13例无出血,有下腹痛伴或无下坠感3例,35例无腹痛或下坠感,停经周数5~10周,平均(6.81±1.10)周,1次剖宫产史12例,2次剖宫产史26例,距末次剖宫产手术时间为1~9年,平均(4.69±2.65)年,术前血清β-人绒毛膜促性腺激素(β-human chorionic gonadotropin,β-HCG)629.30~152 125.02 U/L,中位水平13 770.00 U/L,妊娠囊大小0.4~3.8 cm,平均(1.67±0.81)cm。其中Ⅰ型14例(12例孕周5~8周,2例孕周≥8周),Ⅱ型12例,Ⅲ型12例。
1.2 诊疗方法 采用GE-E8、ALOKA彩色多普勒超声显像仪,经阴道超声探头,频率6~9 MHz所有患者先排空膀胱,均接受经阴道扫查子宫及附件区,着重观察子宫下段结构和宫颈结构,记录病灶位置、大小、回声、血流情况及孕囊发育情况等,在子宫纵切面测量孕囊或包块与膀胱间子宫肌层的厚度。在超声分型共识前提下,超声诊断要点如下:①正确识别切口瘢痕;②确认切口瘢痕处有无绒毛组织,稍高回声的绒毛膜组织或稍高回声的胎盘组织附着于切口瘢痕处的声像表现是诊断CSP的特征性征象;同时对瘢痕处滋养层血流信号行主观半定量评估:彩色取样框包含子宫下段结构、宫颈结构,分为4类:无血流;少量(星点状)血流;中等量血流及丰富血流信号。
1.2.1 Ⅰ型(孕周<8周) 米非司酮总量150 mg分两日服用,第1天晨服50 mg,12 h再服25 mg;第2天,早晚各服25 mg,第3天上午7时再服25 mg;6 h后行超声监测下清宫术,彩色多普勒血流显像(color Doppler flow imaging,CDFI):瘢痕处见滋养层血流信号,呈中等量或丰富血流信号时,术前要备子宫动脉栓塞术,术中及术后超声监测子宫前壁下段情况(图1,2)。
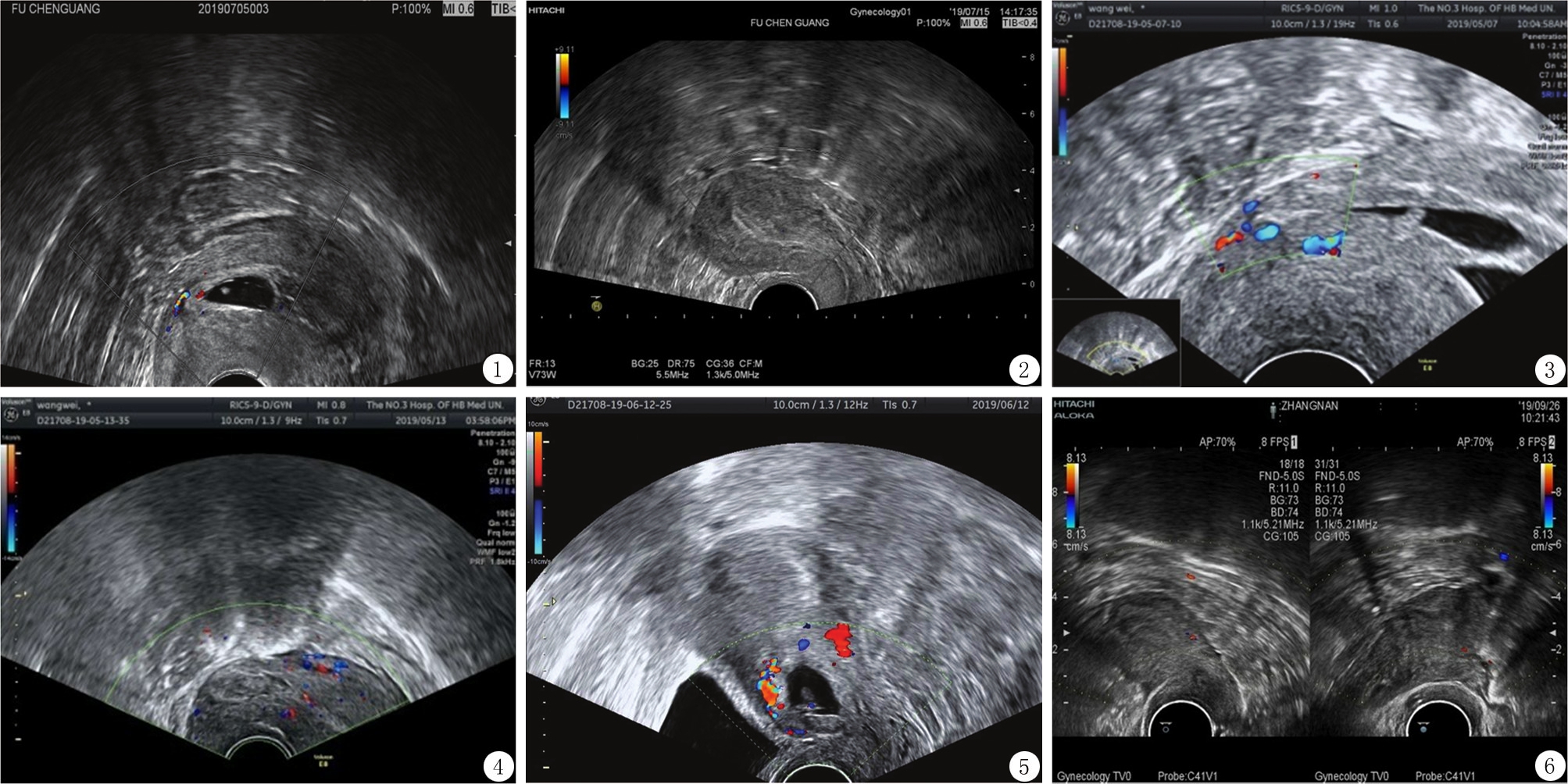
图1 Ⅰ型术前(少量血流信号) Figure 1 Pre-operation of typeⅠ(small blood flow signal)
图2 Ⅰ型术后1周 Figure 2 One week after the operation of typeⅠ
图3 Ⅱ型术前(中等量血流信号) Figure 3 Pre-operation of type Ⅱ(moderate blood flow signal)
图4 清宫术后瘢痕处包块 Figure 4 The sonographic mass after curettage
图5 Ⅲ型术前(血流信号丰富) Figure 5 Pre-operation of type Ⅲ(rich blood flow signal)
图6 Ⅲ型术后3个月 Figure 6 Three months after the operation of type Ⅲ
1.2.2 Ⅰ型(孕周≥8周)及部分Ⅱ型 均予氨甲喋呤(methotrexate,MTX)50 mg/m2全身单剂量肌肉注射行预处理,48 h后超声监测下行清宫术。其中12例患者子宫前壁瘢痕处肌层厚度>2 mm,CDFI:瘢痕处见少量低阻星点状血流信号。另1例瘢痕处肌层菲薄,浆膜层连续尚完整,局部未凸向膀胱。CDFI:瘢痕处见中等量血流信号,考虑绒毛种植深,建议患者腹腔镜手术,拒绝,要求行清宫术。预处理同前,术中出血多约100 mL,宫腔下段放置Foley导尿管,24 h后取出,有研究报道Ⅰ、Ⅱ型剖宫产瘢痕部位妊娠患者清宫术后,宫腔放置Foley导尿管,能有效止血[2]。术后3 d超声提示子宫前壁下段回声不均区,浆膜层连续性好,无血流信号,考虑子宫瘢痕处血肿形成,交代病情并给予抗炎止血药物治疗,术后观察阴道出血不多,HCG下降满意(图3,4)。
1.2.3 部分Ⅱ型及Ⅲ型 腹腔镜妊娠物清除术及子宫瘢痕修补术 1例Ⅱ型肌层薄(CDFI:瘢痕处见丰富滋养层血流信号)及12例Ⅲ型手术治疗,术前均予MTX50 mg/m2单剂量肌肉注射预处理。手术操作举例:术中探查子宫前位增大如孕2个月大小,子宫前壁下段瘢痕处膨出,约2 cm×2 cm大小,呈紫蓝色,转台下行清宫术,7号吸管吸出部分妊娠组织,后转至台上行子宫瘢痕修补术,电钩分开膀胱腹膜反折部位,仔细分辨膀胱与子宫下段妊娠包块关系,下推膀胱,显示病灶部位,可见此处薄,凸向膀胱,以单极电钩自包块凸起处横行切开长约3 cm至宫腔,切开修剪子宫瘢痕部位陈旧瘢痕组织,清除积血及妊娠组织至新鲜子宫肌层暴露。9361可吸收线连续缝合子宫全层关闭宫腔,同一缝合线连续缝合子宫浆膜层,宫腔内留置双腔尿管,注入生理盐水20 mL压迫止血(图5,6)。对于粘连严重或出血多的患者,如腹腔镜下操作困难,可以中转开腹。1例因粘连严重行开腹手术治疗。
1.3 术后监测 术后1,3,7,14,21及28 d分别监测β-HCG下降情况,直至正常,术后1周超声观察子宫情况,有子宫前壁下段包块者监测包块大小及血流情况至消失。如β-HCG下降不满意(每次下降幅度<15%),或术后28 d未正常,进一步诊疗。
1.4 出院标准 用药或术后每隔1 d复查血β-HCG,下降超过15%,且持续下降,生命体征平稳,为治疗有效,待β-HCG接近正常,可以出院随访。有愿望再次妊娠者,建议Ⅰ型治愈半年后、Ⅱ型及Ⅲ型治愈1年后可以妊娠,并告知如再次妊娠,有发生CSP、胎盘植入、晚期子宫破裂等风险,需加强孕期检查。
1.5 统计学方法 应用SPSS 13.0软件行统计学分析。计量资料比较分别采用两独立样本的t检验、F检验和SNK-q检验,非正态分布计量资料比较采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 3组患者临床参数比较 3组年龄、术前血清β-HCG值、距末次剖宫产时间比较,差异无统计学意义(P>0.05)。孕囊平均径、停经时间比较,差异有统计学意义(P<0.05)。见表1、2。
表1 患者临床参数比较
Table 1 Comparison of clinical data of patients![]()
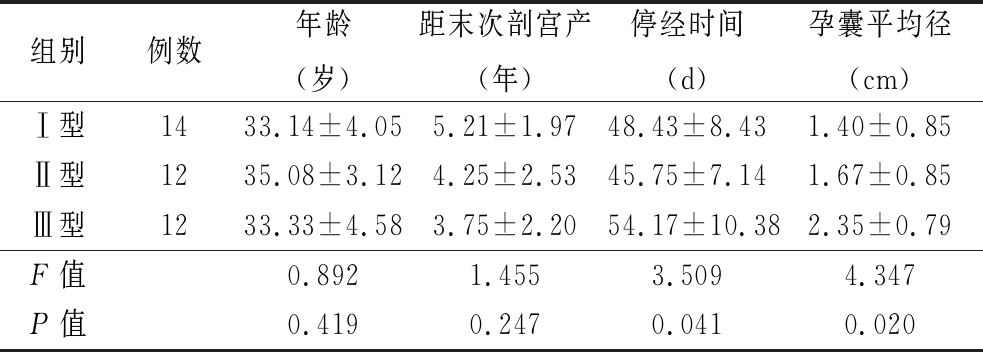
组别例数年龄(岁)距末次剖宫产(年)停经时间(d)孕囊平均径(cm)Ⅰ型1433.14±4.055.21±1.9748.43±8.431.40±0.85Ⅱ型1235.08±3.124.25±2.5345.75±7.141.67±0.85Ⅲ型1233.33±4.583.75±2.2054.17±10.382.35±0.79F值0.8921.4553.5094.347P值0.4190.2470.0410.020
2.2 GSP不同超声分型的治疗 方案1组:Ⅰ型12例(孕周<8周),CDFI:瘢痕处滋养层血流信号,10例为无或少量(星点状)血流信号,2例为中等量血流信号。给予米非司酮总量150 mg预处理后,均行超声监测下清宫术,手术顺利。2组:Ⅰ型2例(孕周≥8周)、Ⅱ型10例,子宫前壁瘢痕处肌层厚度>2 mm,CDFI:瘢痕处见少量星点状低阻血流信号,给予MTX预处理后行超声监测下清宫术,手术顺利,出血均<30 mL,1例显示肌层薄,CDFI:瘢痕处见中等量血流,建议行腹腔镜手术,其拒绝并要求行清宫术,术中出血约100 mL,给予Foley导尿管及止血药物治疗,患者后期阴道出血不多,β-HCG下降满意,14 d出院。3组:腹腔镜手术组:Ⅱ型1例肌层薄,CDFI:瘢痕处见丰富血流信号及Ⅲ型12例,均行腹腔镜手术,术中1例膀胱与子宫下段粘连致密,子宫不完全破裂口,手术困难,出血多,转行开腹手术。见表3。
表2 患者术前血清β-HCG比较
Table 2 Comparison of the preoperative level of β-HCG [M(QR),U/L]
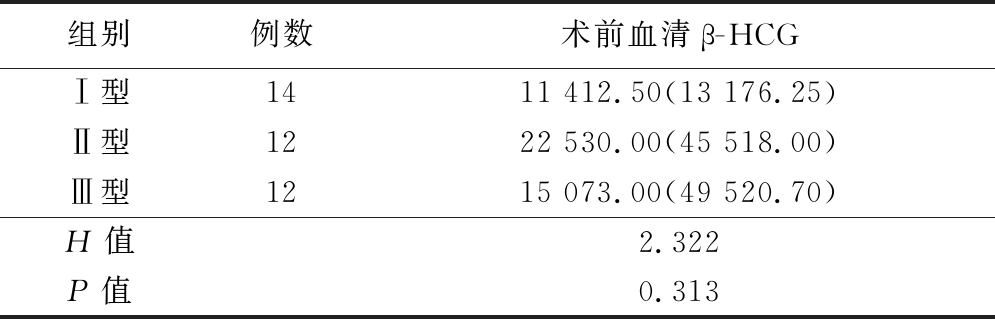
组别例数术前血清β-HCGⅠ型1411 412.50(13 176.25)Ⅱ型1222 530.00(45 518.00)Ⅲ型1215 073.00(49 520.70)H值2.322P值0.313
表3 患者手术时间及术中出血比较
Table 3 Comparison of duration of operation and blood loss during surgery

*P值<0.05与1组比较 #P值<0.05与2组比较(SNK-q检验)
组别例数手术时间(x-±s,min)术中出血[M(QR),mL]1组1210.42±1.4417.50(8.75)2组1311.92±3.84*20.00(0.00)3组1396.15±39.43*#100.00(50.00)F/H值57.29525.522P值<0.001<0.001
2.3 诊疗结果比较 腹腔镜手术组患者术后血清β-HCG值降至正常、住院时间及术后肌层厚度均优于清宫组,差异有统计学意义(P<0.05)。见表4。
表4 患者诊疗结果比较
Table 4 Comparison of treatment and outcome of patients![]()
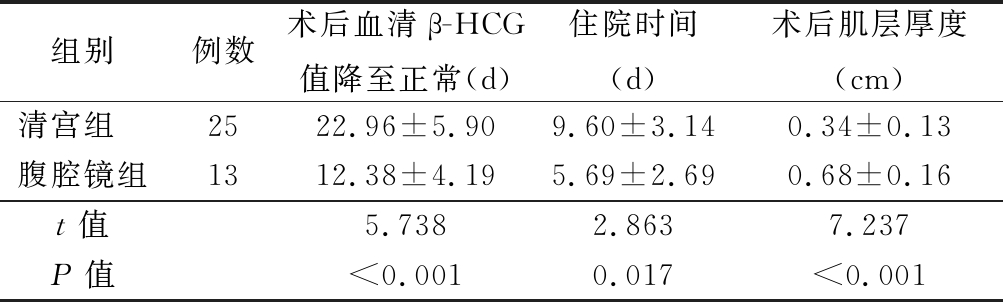
组别例数术后血清β-HCG值降至正常(d)住院时间(d)术后肌层厚度(cm)清宫组 2522.96±5.909.60±3.140.34±0.13腹腔镜组1312.38±4.195.69±2.690.68±0.16t值5.7382.8637.237P值<0.0010.017<0.001
2.4 术后恢复情况及病理 38例均手术成功,手术时间10~90 min,无并发症。住院时间3~14 d。术后病理报告37例提示绒毛和(或)蜕膜组织,1例提示少量绒毛,建议STR分型,患者拒绝,坚持出院后失访。
3 讨 论
CSP为特殊部位的异位妊娠,近期研究表明,CSP的发生率为1∶1 000,分娩率占CSP的1/372,占有前次剖宫产史妇女异位妊娠的6.1%[3-4]。停经后不规则阴道出血,下腹痛和白细胞升高可能是其早期临床特征[5]。临床易与宫颈妊娠、不全流产相混淆,但病史与超声声像特征能够帮助进行鉴别诊断,并为临床制定治疗方案提供相关依据[6]。由于子宫峡部肌层薄,剖宫产切口瘢痕部位收缩能力不佳,CSP在流产或清宫时断裂的血管不能自然闭合,能引起致命的大出血,CSP是一种医源性的并可以发生一系列危害生命状况的疾病[7]。CSP可有不同的临床转归,若为内生型胚囊向宫腔方向生长,可发展为宫内活胎,甚至足月分娩,但有前置胎盘和胎盘植入的风险;若为外生型胚囊向膀胱方向生长,可发展为凶险性前置胎盘,甚至子宫破裂,研究表明后者行腹腔镜手术,术前行子宫动脉栓塞术(uterine artery embolization,UAE)是安全有效的[8],近期也有研究表明,高强度聚焦超声在Ⅱ型患者术前预处理的安全有效性优于前者[9]。目前,CSP尚无标准治疗方案,治疗原则是早期诊断,及时去除妊娠囊,预防大出血并保留生育功能。治疗关键是减少妊娠囊局部的血供后予以清除。随着超声诊断技术的发展,增加了CSP的诊断精准性。新的CSP分型综合了多个临床指标,可以较精准判断终止妊娠时出血风险,为临床治疗方案选择提供依据[10]。近年生育政策放开,我院剖宫产术后子宫瘢痕妊娠患者确诊例数增加,本研究在精准超声分型基础上,选择清宫术及腹腔镜微创手术治疗,取得较好临床疗效。
Ⅰ型及部分Ⅱ型患者由于妊娠囊大部分凸向宫腔生长,且子宫前壁下段肌层相对较厚,CDFI:瘢痕处为无或少量(星点状)低阻滋养层血流信号。大部分可以采用药物杀胚后,行超声引导下定位清宫,减少损伤及出血风险,超声诊断CSP的准确度约为77.27%~82.8%,术中做好随时止血及UAE准备。术前应作出不同分型的临床诊断,不能明确的可以增加MRI。本研究诊疗病例中Ⅰ型及Ⅱ型肌层厚度(≥2 mm),术中出血不多,患者均行清宫术成功,降低了患者住院时间及住院费用。1例Ⅱ型肌层菲薄,CDFI:瘢痕处见中等量滋养层血流信号,术中出血多,术后瘢痕处形成血肿,包块直径约1.5 cm,予止血治疗,后观察β-HCG下降明显,包块减小,未行再次手术,14 d出院,住院时间长,费用增加,同时增加了患者的心理负担。因此,对于此类Ⅱ型患者,尤其有再次生育要求或微创治疗要求的,积极进行腹腔镜下妊娠物清除术及子宫瘢痕修补术是最好选择,对于部分Ⅱ型患者无生育要求,经济条件差可以精准评估后行清宫术。
Ⅱ型、Ⅲ型患者以往常规治疗包括药物治疗、UAE、开腹、宫腔镜、腹腔镜或阴式妊娠物清除术及子宫瘢痕修补术、子宫切除术[11-15]。药物治疗及子宫动脉栓塞术治疗时间长,失败率较高,且不能对子宫瘢痕处缺陷部位进行修补,可能再次发生CSP。我院对于Ⅱ型肌层菲薄或显示不清,CDFI:瘢痕处见中等量或丰富滋养层血流信号及Ⅲ型患者,行腹腔镜下CSP病灶切除术及子宫瘢痕修补术。手术优势在于清除妊娠包块并对瘢痕薄弱区及存在的瘢痕憩室进行修补。与开腹手术相比创伤小,患者临床恢复快,术后3个月复查,该组患者子宫前壁下段肌层厚度较清宫组厚。本研究中应用此种方法治疗的13例患者,术后恢复快,一般术后3~5 d出院,未观察到术后瘢痕憩室存在,1例术后5个月正常妊娠,这为有生育要求的患者诊疗提供了一定临床治疗经验。手术治疗方法对这类病例应该作为首选。研究报道,对于Ⅲ型患者手术治疗是安全有效的。本研究由于随访时间短,临床观察时间有限,腹腔镜术后再次妊娠情况及结局有待进一步研究。有研究表明MTX注射后半年内妊娠并成功分娩,胎儿生后未见异常。及时诊断并根据患者发病时间、孕周、子宫下段肌层厚度、血流情况及生育要求等早期实施个体化诊疗方案。尽量降低患者损伤,治疗彻底,恢复快速,避免中、晚孕期凶险型前置胎盘及胎盘种植引起大出血、降低子宫切除风险,保存生育功能,提高生存质量是遵循的原则。因此,剖宫产术后子宫瘢痕妊娠精准超声分型是必要的,它为采用个体化诊疗提供了依据,为Ⅱ型及Ⅲ型患者治疗提供了新的思路和方法。
[1] 金力,陈蔚琳,周应芳,等.中华医学会妇产科学分会计划生育学组.剖宫产术后子宫瘢痕妊娠诊治专家共识[J]. 中华妇产科杂志,2016,51(8):568-572.
[2] 李婷婷,黎巧,王瑞姣,等.Ⅰ、Ⅱ型剖宫产瘢痕部位妊娠患者清宫术后应用Foley导尿管联合垂体后叶素对出血量和安全性的影响研究[J].中国实用医药,2020,15(11):61-63.
[3] Altay MM,Mert SA,Gemici A,et al. Successful technique of manual vacuum aspiration for treatment of type 2 cesarean scar pregnancies:evaluation of 40 cases[J]. J Matern Fetal Neonatal Med,2019,32(19):1-8.
[4] Liwicka K,Greco E. Caesarean scar pregnancy:a review of management options[J]. Curr Opin Obstet Gynecol,2013,25(6):456-461.
[5] Luo L,Ruan X,Li C,et al. Early clinical features and risk factors for cesarean scar pregnancy:a retrospective case-control study[J]. Gynecol Endocrinol,2019,35(4):337-341.
[6] Jiang F,Jiang F,Su H,et al. Intrauterine ectopic pregnancy-ultrasound typing and treatment[J]. Ginekol Pol,2020,91(3):111-116.
[7] Doroszewska K,Milewicz T,Milewicz T,et al. Cesarean scar pregnancy-various methods of treatment[J]. Folia Med Cracov,2019,59(2):5-14.
[8] Fu LP. Therapeutic approach for the cesarean scar pregnancy[J]. Medicine,2018,97(18):e0476.
[9] 严凤,李全香,魏杏茹,等.高强度聚焦超声治疗剖宫产瘢痕部位妊娠的效果分析[J].河北医科大学学报,2019,40(12):1413-1416.
[10] Sokoowska M,Rajewska A,Mikoajek-Bedner W,et al.Cesarean scar pregnancy-case resports and literature review[J]. Pol Merkur Lekarski,2020,48(285):179-183.
[11] 高然,张燕萍,杨涵,等.宫腔镜联合垂体后叶素治疗剖宫产切口妊娠的临床价值[J].昆明医科大学学报,2014,35(12):112-114.
[12] Li Q,Xu H,Wang Y,et al. Ultrasound-guided local methotrexate treatment for cesarean scar pregnancy in the first trimester:12 years of single-center experience in China[J]. Eur J Obstet Gynecol Reprod Biol,2019,243:162-167.
[13] Kim YR,Moon MJ. Ultrasound-guided local injection of methotrexate and systemic intramuscular methotrexate in the treatment of cesarean scar pregnancy(Article) [J]. Obstet Gynecol Sci,2018,61(1):147-153.
[14] Zhang C,Zhang Y,He J,et al. Outcomes of subsequent pregnancies in patients following treatment of cesarean scar pregnancy with high intensity focused ultrasound followed by ultrasound-guided dilation and curettage[J]. Int J Hyperthermia,2019,36(1):926-931.
[15] 刘春.剖宫产瘢痕部位妊娠的超声分型与治疗方案选择的比较[J/CD].实用妇科内分泌杂志(电子版),2017,4(24):97-99.